工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)冷却过滤的目的______
(2)通入反应器2的SO2作用是______反应器2中发生反应的离子方程式为______
(3)循环使用的物质是______
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是______
(5)通过电解NaClO3水溶液的方法也可以制备NaClO4,进而可以制备HClO4,写出阳极的电极反应式______.
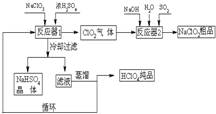
(1)在反应器1中,硫酸钠和硫酸反应获得的硫酸氢钠的溶解度随着温度的降低而减小,这样冷却过滤,可以降低NaHSO4的溶解度并分离出NaHSO4晶体,故答案为:降低NaHSO4的溶解度并分离出NaHSO4晶体;
(2)在反应器2中,可以实现二氧化氯向NaClO2的转化,二氧化硫可以作为还原剂把ClO2还原为NaClO2,
即2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O,
故答案为:二氧化硫作为还原剂把ClO2还原为NaClO2;2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)根据循环图可以发现硫酸作为反应物进入反应器1中,又作为生成物在反应器2中生成,可以循环使用,
故答案为:H2SO4;
(4)根据题意高氯酸的沸点:90°C,可以采用蒸馏滤液的方法得到高氯酸,
故答案为:高氯酸的沸点比较低,容易从溶液中逸出;
(5)电解NaClO3水溶液的电解池中,阳极是ClO3-失电子发生氧化反应的过程,
即电极反应式为:H2O+ClO3--2e-=ClO4-+2H+,
故答案为:H2O+ClO3--2e-=ClO4-+2H+.
