下图是中学常见物质间的转化关系.已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色.
回答下列问题:

(1)A的电子式为______;B分子属于______分子(极性、非极性);
(2)反应①的化学方程式为______,反应②的离子方程式为______,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为______L.
(4)检验K中阳离子常用的方法是______.
(5)L浓溶液的保存方法是______.
A为淡黄色固体,为Na2O2,B为导致“温室效应”的主要物质,为CO2,二者反应生成Na2CO3和O2,生成物能和金属反应的是O2,则C为O2,D为Na2CO3,J为红褐色沉淀,应为Fe(OH)3,所以E为Fe,F为Fe3O4,L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色,应是浓硝酸所具有的性质,则L为HNO3,K为Fe(NO3)3,H为NaOH,G在实验室中常用于检验CO2的存在,则G为从Ca(OH)2,则
(1)A为Na2O2,为离子化合物,电子式为
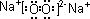
,B为CO2,由结构式O=C=O可以看出,应为含有极性键的非极性分子,故答案为:
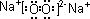
,非极性;
(2)反应①为Na2O2和CO2的反应,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑,反应②为Fe(NO3)3和NaOH的反应,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,
故答案为:2Na2O2+2CO2=2Na2CO3+O2↑;Fe3++3OH-=Fe(OH)3↓;
(3)n(Na2O2)=
=0.5mol,39g 78g/mol
2Na2O2+2CO2=2Na2CO3+O2↑
2mol 22.4L
0.5mol V
V=
=5.6L,0.5mol×22.4L 2mol
故答案为:5.6;
(4)Fe3+与SCN-反应生成红色物质,检验Fe3+常用的方法是在试管中取少量K溶液,滴加几滴KSCN溶液,若溶液红色,证明有Fe3+,
故答案为:在试管中取少量K溶液,滴加几滴KSCN溶液,若溶液红色,证明有Fe3+;
(5)浓硝酸不稳定,见光易分解,应用棕色试剂瓶低温保存,故答案为:用棕色试剂瓶子保存并放置于低温避光处.
