X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)
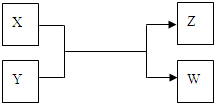
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是______.
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途______.
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是______.
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是______.
(2)若用下列装置只进行Z+W═X+Y反应(夹持装置未画出):
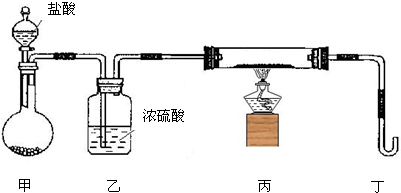
①完成此实验有多步操作,其中三步是:
a.点燃酒精灯
b.滴加盐酸
c.检验气体纯度
这三步操作的先后顺序是______(填字母).
②为保证实验成功,上述装置需要改进,方法是(用文字叙述)______.
(3)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液______mL (精确到0.1).
Ⅰ.若W遇淀粉溶液变蓝,w是碘单质,X和Y反应生成碘和Z,Z是生活中常用的调味品,Z是氯化钠,根据元素守恒、氧化还原反应及X和W是单质、Y和Z为化合物知,X是氯气,Y是碘化钠;
(1)通过以上分析知,X是氯气,为黄绿色气体,故答案为:黄绿色;
(2)工业上用电解饱和氯化钠溶液制取氢氧化钠,电解方程式为:2NaCl+2H2O
H2↑+Cl2↑+2NaOH, 电解 .
故答案为:2NaCl+2H2O
H2↑+Cl2↑+2NaOH; 电解 .
(3)氯气有强氧化性,能把碘离子氧化生成碘酸根离子,同时自身被还原成氯离子,离子方程式为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+,
故答案为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+;
Ⅱ.若X是工业上用量最大的金属单质,则X是铁,Z是一种具有磁性的黑色晶体,Z是四氧化三铁,X、Y、Z、W四种物质有如下相互转化关系,其中X、W单质,Y、Z为化合物,该反应是铁和水蒸气反应生成氢气和四氧化三铁,所以W是氢气,Y是水.
(1)高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O
Fe3O4+4H2,故答案为:3Fe+4H2O 高温 .
Fe3O4+4H2; 高温 .
(2)①氢气还原氧化物的实验中,因为氢气和氧气在一定范围内会产生爆炸,所以实验应该先制取氢气,然后检验氢气再通入氢气,通入一段时间后再点燃酒精灯,所以实验顺序为b、c、a,故答案为:b c a;
②该反应是放热反应,盐酸检验挥发性,所以制取的氢气中含有氯化氢气体,为防止氯化氢气体干扰实验,应该在甲、乙装置中间增加一个装有水的洗气瓶,洗气氯化氢气体,
故答案为:在甲、乙装置中间增加一个装有水的洗气瓶;
(3)四氧化三铁和硝酸反应生成硝酸盐和NO,向溶液中滴加氢氧化钠溶液,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,根据溶液中硝酸根离子的量计算氢氧化钠的浓度,
硝酸的物质的量=4mol/L×0.05L=0.2mol,充分反应,产生112mL的NO,根据氮原子守恒,硝酸和一氧化氮的物质的量之比为1:1,则溶液中剩余硝酸的物质的量=0.2mol-
=0.195mol,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,则氢氧化钠和硝酸根离子之间的物质的量之比为1:1,设氢氧化钠的体积为V.0.112L 22.4L/mol
NaOH------NO3-,
1mol 1mol
2V 0.195mol
V=97.5mL,
故答案为:97.5.
