A、B、C、D、E五种短周期元素,原子序数依次增大.A元素的单质是自然界最轻的气体,E单质须保存在煤油中.A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;
回答下列问题:
(1)N的电子式为______;M分子中含有______(填“极性”或“非极性”)键
(2)D与E以1:1形成的化合物与水反应的化学反应方程式______
(3)A、B、C、D可形成阳离子和阴离子个数比是1:1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1:2加热反应,写出反应的化学方程式______.反应后水溶液显______(填“酸”“碱”或“中”)性,原因是______(用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质.则其负极反应为______;一段时间后,溶液pH______(填“增大”“减小”或“不变”).
(5)在一定温度下,将4mol C单质和12mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为______;该温度下的平衡常数为K=______.从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是______(选填序号字母).
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质.
A、B、C、D、E五种短周期元素,原子序数依次增大.A元素的单质是自然界最轻的气体,应为H,E单质须保存在煤油中,应为Na,A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质,则M为CH4,B为C,D元素最外层电子数是次外层电子数的3倍,应为O,则N为NH3,C为N,
即A为H,B为C,C为N,D为O,E为Na,
(1)N为NH3,电子式为
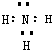
,分子中含有N-H键,为极性键,故答案为:
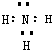
; 极性;
(2)D与E以1:1形成的化合物为Na2O2,与水反应的化学反应方程式为2Na2O2+2CO2═2Na2CO3+O2↑,
故答案为:2Na2O2+2CO2═2Na2CO3+O2↑;
(3)化合物X为NH4HCO3,Y为NaOH,二者反应的化学方程式为NH4HCO3+2NaOH
Na2CO3+NH3↑+2H2O, △ .
反应溶液的溶质为Na2CO3,由于发生CO32-+H2O

HCO3-+OH-,则溶液呈碱性,
故答案为:NH4HCO3+2NaOH
Na2CO3+NH3↑+2H2O;碱;CO32-+H2O △ .

HCO3-+OH-;
(4)NH3、O2和KOH形成的原电池中,NH3被氧化生成N2,则负极反应为2NH3-6e-+6OH-═N2+6H2O,
反应的总方程式为4NH3+3O2=2N2+6H2O,溶液体积增大,OH-浓度减小,则溶液pH减小,
故答案为:2NH3-6e-+6OH-═N2+6H2O;减小;
(5)N2+3H2

2NH3
起始:2mol/L 6mol/L 0
转化:1mol/L 3moL/L 2moL/L
平衡:1mol/L 3moL/L 2moL/L
则v(N2)=
=0.5mol/L-1min-1,k=1mol/L 2min
=22 1×33
,4 27
提高H2单质的转化率可以采取:增大压强,及时分离出生成物以及平衡后再加入2molN2物质,如平衡后再加入6molH2物质,则H2的转化率减小,加入催化剂平衡不移动,
故答案为:0.5mol/L-1min-1;
;a、c、e.4 27
