短周期元素组成的四种物质A、B、C、D均溶于水,A、C焰色反应呈黄色.取四种物质的溶液进行如下实验:
①分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,B中无变化.
②物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体.如果均以1:1混合,均无气体生成.
③D+AgNO3→不溶于稀HNO3的白色沉淀.
④向D中逐滴滴加C生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.
请回答
(1)D中阴离子在周期表中的位置______;C的电子式______
(2)A溶液的PH______7(填>=<=),原因:______
(3)A、D两溶液混合,有气体和白色沉淀产生,写出反应的离子方程式:______
(4)将②中产生的两种气体通入浓CaCl2溶液中可制备纳米级碳酸钙,制备时应先通入______气体(填化学式),写出反应的化学方程式______
(5)设计实验验证所得样品颗粒是否为纳米级______.
A、C焰色反应呈黄色说明含钠元素,分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,推断A为Na2CO3,B中无变化,说明沉淀不溶于硝酸;推断为BaSO4,A中可能含有亚硫酸根离子或硫酸根离子,物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体,证明B含有HSO4-;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体说明为NH3.说明B中含有铵根离子,如果均以1:1混合,均无气体生成,证明B为NH4HSO4,C为NaOH;D+AgNO3→不溶于稀HNO3的白色沉淀.证明D中含有氯离子,向D中逐滴滴加C(NaOH)生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.证明生成的白色沉淀是氢氧化铝;D为氯化铝;综上所述:推断出的物质为:A、Na2CO3 ,B、NH4HSO4 ,C、NaOH,D、AlCl3,
(1)D中阴离子为Cl-,氯元素在周期表中的位置,第三周期 VIIA族;C为NaOH,它的电子式为:Na+
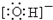
,故答案为:第三周期 VIIA族;Na+
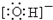
;
(2)A溶液是Na2CO3的溶液,碳酸根离子水解显碱性,PH>7;离子方程式表示的原因:CO32-+H2O

HCO3-+OH-,故答案为:>;CO32-+H2O

HCO3-+OH-;
(3)A(Na2CO3 )、D(AlCl3)两溶液混合,碳酸根离子和铝离子发生双水解生成气体二氧化碳和白色沉淀氢氧化铝,反应的离子方程式:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(4)将②中产生的两种气体为二氧化碳和氨气,通入浓CaCl2溶液中可制备纳米级碳酸钙NH3,依据候氏制碱法的原理结合反应的性质特征,制备时应先通入氨气,再通入二氧化碳和氨气产生碳酸盐,进而生成碳酸钙;反应的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl,故答案为:NH3;CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl;
(5)纳米级碳酸钙与水混合形成了胶体分散系,利用胶体的性质丁达尔现象分析验证,方法为:取少量样品和水混合形成分散系,用一束光照射,若出现一条光的通路则是,否则不是;故答案为:取少量样品和水混合形成分散系,用一束光照射,若出现一条光的通路则是,否则不是.
