已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6.M与其他物质的转化关系如下(部分产物已略去):
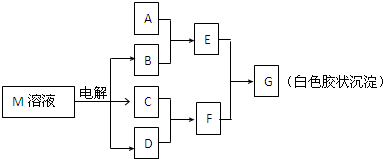
(1)工业电解M溶液的化学方程式为______.
(2)若A是X、Y同周期的一种常见金属,则A元素在周期表中的位置是______周期______族,写出A与B溶液反应的化学方程式是______.
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为______,写出E与F反应的离子方程式是______.
(4)B的电子式为:______,其中的化学键为:______.
(5)说明M物质的一种用途:______.
X、Y是短周期元素,X原子的最外层电子数是最内层电子数的一半,该元素可能是Li或Na元素,Y元素最高正价与它的负价代数和为6,最高正价与最低负价的绝对值是8,O元素没有正价,则Y是Cl元素,X和Y是同一周期元素,X是Na元素,Y是Cl元素,则M是NaCl;电解氯化钠溶液生成氢氧化钠、氯气和氢气;
(1)电解氯化钠溶液生成氢氧化钠、氯气和氢气,电解方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑, 电解 .
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑; 电解 .
(2)若A是X、Y同周期的一种常见金属,则A是金属Al,铝原子核外有3个电子层,最外层有3个电子,所以其在周期表中处于第三周期、IIIA族,Al能和氢氧化钠溶液反应,所以B是氢氧化钠,氢氧化钠、铝和水反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:第三周期、IIIA族,2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)制造光导纤维的主要原料是二氧化硅,所以A是二氧化硅,硅的原子结构示意图为
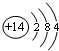
,二氧化硅能和氢氧化钠溶液反应生成硅酸钠和水,所以B是氢氧化钠,C和D反应生成氯化氢,硅酸钠和盐酸反应生成硅酸和氯化钠,离子反应方程式为2H++SiO32-=H2SiO3↓,
故答案为:
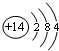
;2H++SiO32-=H2SiO3↓;
(4)通过以上分析知,B是氢氧化钠,氢氧化钠电子式为:
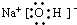
,氢氧化钠中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在极性共价键;
故答案为:
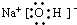
;离子键和极性键;
(5)氯化钠可用于氯碱工业,故答案为:氯碱工业.
