A、B、C、D为同一周期的四种元素,原子序数依次增大,已知0.2摩A与酸充分反应时,在标况下可生成2.24升氢气;B的氧化物既可溶于强酸又可溶于强碱溶液;C、D阴离子的电子层结构与氩原子相同,C的气态氢化物与C的低价氧化物反应,又可得到C的单质.试回答:
(1)A、B、C、D的元素符号分别为______、______、______、______.
(2)用电子式表示A与C形成化合物的过程:______.
(3)写出B的氧化物与A的氢氧化物反应的离子方程式:______.
(4)写出实验室制备D的单质的化学反应方程式:______.
A、B、C、D为同一周期的四种元素,原子序数依次增大,B的氧化物既可溶于强酸又可溶于强碱溶液,则B为铝元素;0.2摩A与酸充分反应时,在标况下可生成2.24升氢气,A为金属,氢气的物质的量为0.1mol,令A的化合价为x,根据电子转移守恒,0.2x=0.1mol×2,解得x=1,所以A处于ⅠA族,故A为钠元素;C、D阴离子的电子层结构与氩原子相同,原子序数C<D,故C为硫元素,D为氯元素,硫化氢与二氧化硫反应生成硫单质,符合题意.
故A为钠元素,B为铝元素;C为硫元素,D为氯元素.
(1)由上述分析可知,A为Na;B为Al;C为S;D为Cl.
故答案为:Na、Al、S、Cl.
(2)A为钠元素,C为硫元素,A与C形成化合物为Na2S,用电子式表示Na2S形成化合物的过程为
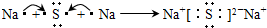
.
故答案为:
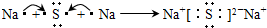
.
(3)B的氧化物为Al2O3,A的氢氧化物NaOH,氧化铝与氢氧化钠反应生成偏铝酸钠与氢气,二者反应的离子方程式为Al2O3+2OH-=AlO-+H2O.
故答案为:Al2O3+2OH-=AlO-+H2O.
(4)D为氯元素,单质为氯气,实验室制备氯气的化学反应方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O. △ .
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O. △ .
