由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
请回答下列问题:
(1)反应①的离子方程式为:______.
(2)过量的铁与G的热的浓溶液反应时,所得气体是:______.
(3)在一定条件下,9g液态F与40g E气体反应生成液态G时放出热量65.15kJ,则表示该反应的热化学方程式为:______.
(4)C是一种重要的化工产品,为易挥发红色液体.若反应②中生成的G和A的物质的量之比为1:2,则C的电子式为______.
(5)实验室制取B的化学方程式为:______;对气体B进行如下实验:已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023个.请填空:
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通 入淀粉KI溶液 | 溶液最初变成______色 | ______ (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | ______ (用化学方程式表示) |
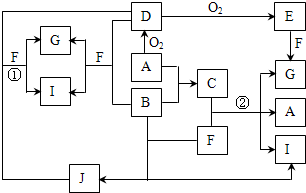
已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成,突破口在固体单质A
能够被连续氧化,A和氧气反应生成D为气体,说明A为固体非金属单质,依据所学可知A为S,D为SO2;E为SO3;G为H2SO4;A和G的浓溶液加热时反应生成D和F,F为H2O;依据B+D→G+I,生成硫酸和盐酸,说明是二氧化硫被氧化为硫酸,已知A、B为同周期相邻元素的单质,则B为Cl2;根据各物质间的相互转化关系,结合所学知识,A、B、D、E、F、G、I、J分别为S,Cl2,SO2,SO3,H2O,H2SO4,HCl,HClO;又根据(4)中“若反应②生成的H2SO4、S、HCl的物质的量之比为1:2,所以C为SCl2,
(1)依据分析判断,反应①是次氯酸和二氧化硫在水溶液中的反应,氯水氧化二氧化硫为硫酸,本身被还原为氯化氢,反应的离子方程式为:HClO+SO2+H2O=3H++SO42-+Cl-;
故答案为:HClO+SO2+H2O=3H++SO42-+Cl-;
(2)足量铁与H2SO4的热的浓溶液反应,开始是生成二氧化硫气体,随着反应进行浓硫酸变稀后,过量的铁和稀硫酸反应生成氢气,所得气体是二氧化硫和氢气;
故答案为:SO2、H2;
(3)在一定条件下,9g液态F为(H2O)与40g E(SO3)气体反应生成液态G(H2SO4)时放出热量65.15kJ,n(H2O)=
=0.5mol;n(SO3)=9g 18g/mol
=0.5mol;依据热化学方程式的书写方法标注物质聚集状态,反应的反应焓变,则表示该反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l);△H=-130.3 kJ/mol;40g 80g/mol
故答案为:SO3(g)+H2O(l)=H2SO4(l);△H=-130.3 kJ/mol;
(4)若反应②中生成的G和A的物质的量之比为1:2,依据产物和原子守恒,配平得到C为SCl2,化学方程式为:3SCl2+4H2O=H2SO4+2S↓+6HCl,C的电子式为:
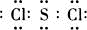
;故答案为:
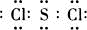
(5)实验室制取Cl2的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;将少量气体Cl2通入淀粉KI溶液中反应生成碘单质,单质碘遇淀粉变蓝;反应的离子方程式为:Cl2+2I-=2Cl-+I2;继续通入气体Cl2,溶液逐渐变成无色,说明碘单质被通入的氯气氧化为高价态的化合物,依据电子守恒计算得到,整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023个,物质的量为0.6mol;反应Cl2+2I-=2Cl-+I2;0.1molI-被氧化转移电子数为0.1mol;生成I2物质的量为0,05mol,设碘单质变化合价升高为x价,I2~2I~2x;得到2x×0.05mol=0.5mol;x=5,所以碘单质被氧化为+5甲碘酸,依据原子守恒和配平方法写出化学方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;故答案为:5Cl2+I2+6H2O=10HCl+2HIO3; △ .
