以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体.
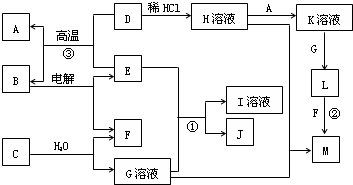
请回答下列问题:
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)若将H溶液加热蒸干、灼烧,最终得到的固体物质的化学式______.
(4)写出①反应的离子方程式______.
(5)写出②、③反应的化学方程式②______,③______.
C为淡黄色固体,能与水反应生成G溶液与F气体单质,故C为Na2O2,G为NaOH,F为O2;
D为红棕色粉末,为Fe2O3,M为红褐色固体,为Fe(OH)3,由D
H溶液,H溶液盐酸
M可知,H为FeCl3,由HNaOH溶液
K溶液A
LNaOH溶液
Fe(OH)3,故L为Fe(OH)2,A是金属,故A为Fe,K为FeCl2;O2
由反应③Fe2O3+金属E
Fe+B,考虑铝热反应,E为Al,B为Al2O3,电解Al2O3生成Al与O2,符合转化关系,由反应①Al与NaOH溶液反应生成NaAlO2与H2,J为气体单质,故J为H2,I为NaAlO2,高温
(1)由上述分析可知,B为Al2O3;
故答案为:Al2O3;
(2)C为Na2O2,与水反应为2Na2O2+2H2O=4NaOH+O2↑,反应中O元素化合价由-1价降低为-2价,由-1升高为0价,Na2O2既是氧化剂又是还原剂,各占
,19.5gNa2O2的物质的量为1 2
=0.25mol,Na2O2完全反应转移电子物质的量为0.25mol×19.5g 78g/mol
×2=0.25mol;1 2
故答案为:0.25;
(3)FeCl3溶液中存在平衡FeCl3+3H2O⇌Fe(OH)3+3HCl,加热蒸干,HCl挥发,促进水解彻底,生成Fe(OH)3,灼烧Fe(OH)3分解生成Fe2O3与水,故最终得到的固体物质是:Fe2O3;
故答案为:Fe2O3;
(4)反应①是Al与NaOH溶液反应生成NaAlO2与H2,反应离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=AlO2-+3H2↑;
(5)反应②是Fe(OH)2被O2氧化为Fe(OH)3,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
反应③是Al与Fe2O3在高温条件下反应生成Fe与Al2O3,反应方程式为:Fe2O3+2Al
2Fe+Al2O3; 高温 .
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe2O3+2Al
2Fe+Al2O3. 高温 .
