右图每一方框中的字母代表一种反应物或生成物.产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质.试填写下列空白:
(1)框图中所列物质中属于非电解质的物质的化学式是______;
(2)用电子式表示出H的形成过程______;
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学式为______;
(4)F的水溶液中各离子浓度由大到小的顺序为______;
(5)F的水溶液显碱性的原因:(用离子方程式表示)______;
(6)E与F在L中反应的离子方程式为______;
(7)H和G之间反应的化学方程式为______.
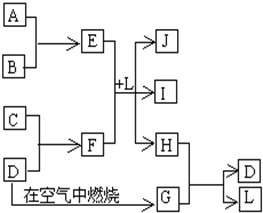
(1)从“D是淡黄色固体单质”可初步认定是硫,G是二氧化硫;从“J是含A金属元素的胶状白色沉淀”可初步认定A是铝,J是氢氧化铝;从“I为NaCl溶液”可推出C为钠,F为硫化钠,B为Cl2,E为AlCl3,L为H2O,H为H2S,H2S与SO2间发生氧化还原反应生成S和H2O,其中只有SO2为非电解质,故答案为:SO2;
(2)H为H2S,用电子式表示的形成过程为

,
故答案为:

;
(3)E为AlCl3,加热时发生水解生成氢氧化铝,氢氧化铝在高温下分解生成Al2O3和H2O,最后得到的固体为Al2O3,
故答案为:Al2O3;
(4)F为硫化钠,在溶液中存在S2-+H20

HS-+OH-,以及HS-++H20

H2S+OH-,则有C(OH-)>C(HS-),由于水解程度较小,则C(S2-)>C(HS-),所以溶液中的离子浓度关系为C(Na+)>C(S2-)>C(OH-)>C(HS-)>C(H+),故答案为:C(Na+)>C(S2-)>C(OH-)>C(HS-)>C(H+);
(5)F为硫化钠,在溶液中存在S2-+H20

HS-+OH-(主要),以及HS-++H20

H2S+OH-(次要),则有C(OH-)>C(H+),所以溶液呈碱性,
故答案为:S2-+H2O

HS-+OH-;
(6)E为AlCl3,为强酸弱碱盐,F为硫化钠,为强碱弱酸盐,二者在L(H2O)中发生相互促进的水解,反应的离子方程式为3Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑,
故答案为:3Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;
(7)H为H2S,G是SO2,SO2具有氧化性,H2S具还原性,二者发生氧化还原反应生成S和H2O,反应的方程式为2H2S+SO2═3S+2H2O,
故答案为:2H2S+SO2═3S+2H2O.
