中学化学中几种常见物质的转化关系如下:
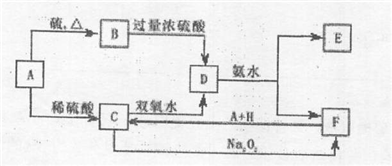
将D溶液滴入沸水中可得到以F为分散质的红褐色液体.请回答下列问题:
(1)红褐色液体分散质粒子直径大小的范围是______,将少量E溶液滴加到红褐色液体中会产生明显现象的过程叫______,E中阳离子的空间构型是______.
(2)B的化学式:______.
(3)将C与Na2O2按物质的量之比为l:1在水溶液中混合后,除有F外还有气体生成.则下列说法正确的是______.
A.该气体一定是氧气 B.Na2O2只是氧化剂
C.Na2O2既是氧化剂又是还原剂 D.反应后静置所得溶液呈黄色
(4)用化学用语回答下列问题:
①写出C的溶液(A→C稀硫酸过量)与双氧水反应的离子方程式:______.
②写出B与过量浓硫酸反应的离子反应方程式:______.
③写出F与A和H混合后反应生成C的离子方程式:______.
将D溶液滴入沸水中可得到以F为分散质的红褐色液体,说明F为Fe(OH)3;证明D为硫酸铁,E为硫酸铵;有转化关系可知,C为硫酸亚铁,推断A为Fe;B为FeS,H为硫酸;根据判断出的物质回答问题:综上所述各物质为:A、Fe;B、FeS;C、FeSO4;D、Fe2(SO4)3;E、(NH4)2SO4;F、Fe(OH)3;H、H2SO4;
(1)红褐色液体是氢氧化铁胶体,分散质粒子直径大小的范围是1nm-100nm,将少量(NH4)2SO4溶液滴加到红褐色液体氢氧化铁胶体中会形成沉淀,过程叫聚沉;铵根离子的空间结构式正四面体结构;故答案为:1nm-100nm;聚沉;正四面体;
(2)依据推断可知B的化学式为:FeS;故答案为:FeS;
(3)将FeSO4与Na2O2按物质的量之比为l:1在水溶液中混合后,除有Fe(OH)3沉淀外还有气体O2生成,
A、气体一定是过氧化钠和水反应生成的氧气,故A正确;
B、过氧化钠既作氧化剂又做还原剂,化合价从-1价变为-2价和0价,故B错误;
C、过氧化钠既作氧化剂又做还原剂,化合价从-1价变为-2价和0价,故C正确;
D、反应后生成氢氧化铁沉淀物三价铁离子,故溶液不是黄色,故D错误;
故选AC.
故答案为:AC.
(4)①FeSO4的溶液(A→C稀硫酸过量)与双氧水在酸性溶液中反应,亚铁离子被过氧化氢氧化为三价铁,过氧化氢被还原为水,的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;
②FeS与过量浓硫酸反应,被氧化为三价铁和二氧化硫,反应的离子反应方程式为:3FeS+10H2SO4(浓)=3Fe2(SO4)3+9SO2↑+10H2O;
③Fe(OH)3与Fe和H2SO4混合后反应生成FeSO4的离子方程式为:2Fe(OH)3+Fe+6H+=3Fe2++6H2O;
故答案为:①2Fe2++H2O2+2H+=2Fe3++2H2O;②3FeS+10H2SO4(浓)=3Fe2(SO4)3+9SO2↑+10H2O;③2Fe(OH)3+Fe+6H+=3Fe2++6H2O;
