已知a、e、I为三种由短周期元素构成的10个电子的粒子,其结构特点如下:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
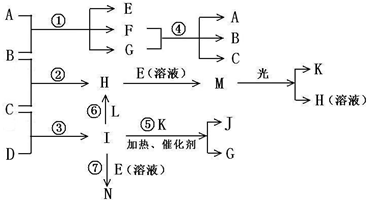
(1)写出下列物质的化学式:B______,J______.
(2)写出下列反应的离子反应方程式:H+E(溶液)→M______,F+G→A+B+C______;
(3)E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式______;
(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,写出L

的电子式______;
(5)常温下,实验室模拟工业反应④的过程如图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=______.(假设气体完全逸出,溶液体积不变)
根据原子核数和带电荷数可知a为Na+,e为OH-,I为NH3,物质A由a、e 构成,应为NaOH,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,能与NaOH反应的工业生成为工业制备漂白液的反应,为Cl2和NaOH的反应,则B为Cl2,C为H2,D为N2,H为HCl,反应④应为工业电解饱和食盐水,则E为NaClO,M为HClO,见光分解生成氧气,则K为O2,和O2反应生成NO和H2O,则G为H2O,J为NO,F为NaCl,E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,反应的方程式为NaOCl+2NH3=N+NaCl+H2O,根据质量守恒可知N为N2H4,各原子均已达到惰性气体的稳定结构,电子式应为
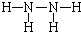
,L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素
CO(NH2)2和物质H,因H为HCl,则L含有C、O、Cl三种元素,结合质量守恒可知L应为COCl2,反应的方程式
为COCl2+2NH3=CO(NH2)2+2HCl,
(1)由以上分析可知B为Cl2,J为NO,故答案为:Cl2;NO;
(2)H+E(溶液)→M的离子方程式为H++ClO-═HClO,F+G→A+B+C为工业电解饱和食盐水的反应,反应的离子方程式为
2Cl-+2H2O
Cl2+H2+2OH-, 电解 .
故答案为:H++ClO-═HClO; 2Cl-+2H2O
Cl2+H2+2OH-; 电解 .
(3)由以上分析可知N的电子式为
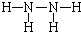
,故答案为:
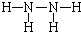
;
(4)L为COCl2,电子式为

,故答案为:

;
(5)B为Cl2,反应的方程式为2Cl-+2H2O
Cl2+H2+2OH-,n(Cl2)= 电解 .
=0.005mol,则生成n(OH-)=0.01mol,0.112L 22.4L/mol
c(OH-)=
=0.1mol/L,则pH=13,0.01mol 0.1L
故答案为:13.