A-M分别代表一种物质.其中,A、D、I、M的焰色反应呈紫色(透过蓝色钴玻璃),实验室常用I在MnO2催化作用下加热制备氧气;B、C是短周期元素组成的气体单质,且C为黄绿色;E是短周期元素组成的常见金属单质,它既能与D溶液反应,也能与G溶液反应.
请回答下列问题:
(1)组成E的元素位于周期表中第______周期,______族.
(2)C与H反应得到的含氧酸的电子式为______.
(3)E与D溶液反应的离子方程式是______.
(4)向M溶液中逐滴加入G溶液至过量的现象是______.
(5)在加热条件下K与碳酸钾反应的化学方程式是______.
(6)在足量的稀硫酸中,I与A以物质的量之比1:1反应,可以得到一种高效消毒剂ClO2及其他产物,该反应的化学方程式是______.
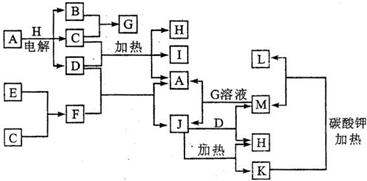
A、D、I、M的焰色反应呈紫色(透过蓝色钴玻璃),都含有K元素,实验室常用I在MnO2催化作用下加热制备氧气,I为KClO3,B、C是短周期元素组成的气体单质,且C为黄绿色,C为Cl2;
A+H
B+Cl2+D,电解生成3种物质,B是短周期元素组成的气体单质,为电解电解质与水型,A含有K元素,故A为KCl,H为H2O,B为H2,D为KOH,由B+C→G可知,G为HCl,E是短周期元素组成的常见金属单质,它既能与KOH溶液反应,也能与HCl溶液反应,故E为Al,由E+G→F可知,F为AlCl3,由F+D→A+J,J电解
H+K可知,J为Al(OH)3,K为Al2O3,由A+J→M+H可知,M为KAlO2,由K+碳酸钾加热
M+L可知,L为CO2.加热
(1)由上述分析可知,E为金属Al,铝是13号元素,处于周期表中第三周期第ⅢA族,故答案为:三;ⅢA;
(2)C与H反应为氯气与水反应生成盐酸与次氯酸,次氯酸中氧原子与氯原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,电子式为:

,
故答案为:

;
(3)E与D溶液反应是铝与氢氧化钾溶液反应生成偏铝酸钾与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)向KAlO2溶液中逐滴加入HCl溶液至过量,向生成氢氧化铝,后氢氧化铝溶解,现象是:先生成白色沉淀,后白色沉淀溶解,
故答案为:先生成白色沉淀,后白色沉淀溶解;
(5)在加热条件下Al2O3与碳酸钾反应生成KAlO2与二氧化碳,反应化学方程式为:Al2O3+K2CO3
2KAlO2+CO2↑, △ .
故答案为:Al2O3+K2CO3
2KAlO2+CO2↑; △ .
(6)令KCl中Cl元素在氧化产物中的化合价为a,则(5-4)=[a-(-1)],解得a=0,故还生成氯气,反应方程式为:2KClO3+2KCl+5H2SO4=2K2SO4+2ClO2↑+Cl2↑+2H2O,
故答案为:2KClO3+2KCl+5H2SO4=2K2SO4+2ClO2↑+Cl2↑+2H2O.
