已知化合物A、B、D各由两种元素组成,C是光合作用的主要产物;甲、乙、丙是前两周期元素的三种单质.这些常见的化合物与单质之间存在如下关系.回答以下问题:
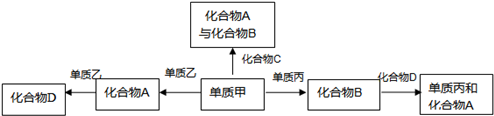
Ⅰ.(1)化合物A的电子式为______;化合物C的结构简式______.
(2)已知常温下测得1g C完全燃烧可放出15.6kJ热量,则C完全燃烧的热化学方程式可表示为:______.
(3)下列说法正确的是______.
A、上述所涉及的化合物中有两种是电解质 B、图中五个转化关系,有三个是化合反应
C、上述所涉及的化合物的晶体均是分子晶体 D、图中五个转化关系均为氧化还原反应
(4)用甲、丙、乙、硫酸溶液可以构成一原电池,则电极材料可以为______,正极的电极反应式为______.
Ⅱ.向某密闭容器中加入 0.4mol B、0.3mol D和一定量的A三种气体.一定条件下发生反应,各物质浓度随时间的变化如下图中甲图所示.乙图为 t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同条件,所用条件均不同.已知t3~t4阶段为使用催化剂[已知 t0~t1阶段 c ( A)未画出].
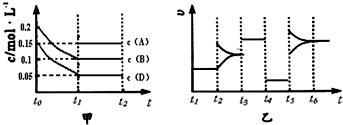
(1)A的起始物质的量为______;
(2)此条件下的化学平衡常数为______;
(3)t4~t5阶段改变的条件为______.
根据置换反应的各种情况,要注意归纳置换反应的各种类型,甲、乙、丙是前两周期元素的三种单质,应为:氢气、碳、氮气、氧气、氟气中的三种,根据框图的要求来选择合适的物质.符合框图的各种物质可以是:A为二氧化碳(CO2),B为水(H2O),C是光合作用的主要产物;判断C为C6H12O6,D为一氧化碳(CO),甲是氧气(O2),乙是碳(C),丙是氢气(H2);
Ⅰ、(1)化合物A是二氧化碳,分子的电子式为:
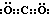
;化合物C为葡萄糖,结构简式为:CH2OH(CHOH)4CHO;故答案为:
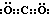
;CH2OH(CHOH)4CHO;
(2)常温下测得1g C(C6H12O6)完全燃烧可放出15.6kJ热量,1mol葡萄糖完全燃烧放热为2808KJ;则C完全燃烧的热化学方程式可表示为:
C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-2808 kJ/mol;
故答案为:C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-2808 kJ/mol;
(3)A、上述所涉及的化合物中,水是一种极弱的电解质,故A错误;
B、五个转化关系中,甲+乙→A、A+乙→D、甲+丙→B共三个是化合反应,图中五个转化关系,有三个是化合反应,故B正确;
C、上述所涉及的化合物的晶体是葡萄糖、水、二氧化碳、一氧化碳均是分子晶体,故C正确;
D、五个转化关系中,均伴随化合价的变化,均为氧化还原反应,故D正确.
故答案为:B、C、D;
(4)用甲(O2)、丙(H2)、乙(C)、硫酸溶液可以构成一原电池;电极材料可以为石墨,正极上是氧气氮的电子生成氢氧根离子的电极反应,在酸性环境下,氢氧根离子写成水的形式,正极的电极反应式:O2+4e-+4H+=2H2O;故答案为:石墨; O2+4e-+4H+=2H2O;
Ⅱ、(1)依据图象分析起始浓度为0.2mol/L的是B为H2O,0.15mol/L的是D为CO,A为CO2,结合 0.4mol B、0.3mol D和一定量的A三种气体可知容器体积为2L,图象中B消耗0.2mol;D消耗0.2mol;A的平衡物质的量为0.3mol;设A的起始量为X,依据化学平衡三段式列式计算得到:
H2O+CO=CO2 +H2;
起始量(mol) 0.4 0.3 X 0
变化量(mol)0.2 0.2 0.2 0.2
平衡量(mol)0.2 0.1 0.3 0.2
对A的物质的量:x+0.2=0.3
X=0.1mol
(2)平衡浓度分别为:C(H2O )=0.1mol/L;C(CO)=0.05mol/L;C(CO2)=0.15mol/L;C(H2)=0.1mol/L;
K=
=[CO2][H2] [CO][H2O]
=30.1mol/L×0.15mol/L 0.1mol/L×0.05mol/L
(3)t4~t5阶段改变的条件依据图象分析t4~t5阶段平衡不动,速率减小,所以改变的条件是减小压强;
故答案为:(1)0.1mol (2)3 (3)减小压强
