现有四种元素,分别位于元素周期表的前四个不同周期,其原子序数总和为48.由它们可组成甲、乙、丙、丁四种单质和A、B、C、D四种化合物,其中甲、乙为非金属单质,丙、丁为金属单质.这些物质间的转化关系如图所示(反应条件已省略)
请回答下列问题:
(1)组成丁的元素在周期表中的位置______.B的俗名______,C物质的用途之一______.
(2)写出A+乙
B的化学方程式______.△
(3)在加热条件下,丁与气态D可发生反应,该反应的化学方程式为______.
(4)若21.6g A与适量的乙反应生成B,A、B按上述图示转化为溶液I和溶液II(假设各步反应均恰好进行完全);向溶液I中通入______mol Cl2,经充分反应可恰好使溶质的组成与溶液II完全相同.
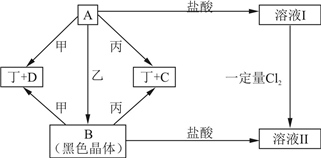
四种元素,分别位于元素周期表的前四个不同周期,它们可组成甲、乙、丙、丁四种单质A、B、C、D四种化合物,
B为黑色晶体,B为Fe3O4,甲、乙为非金属单质,故甲、乙有一种为H2,一种为O2,原子序数总和为48,故另外元素的原子序数为48-1-8-26=13,为Al元素;
丙、丁为金属单质,由A+甲→丁+D及Fe3O4+甲→丁+D可知,丁为Fe,故丙为Al,A与Fe3O4含有相同的元素,甲为H2,D为H2O,故乙为O2,结合A
Fe3O4,得A为FeO,由FeO+Al→Fe+Al2O3,Fe3O4+Al→Fe+Al2O3,故C为Al2O3;乙
FeO
溶液Ⅰ,溶液Ⅰ为FeCl2,Fe3O4+盐酸
溶液Ⅱ,故溶液Ⅱ为FeCl2、FeCl3混合溶液,FeCl2溶液中通入一定量的Cl2,可以得FeCl2、FeCl3混合溶液,盐酸
(1)丁为Fe,Fe元素是26号元素,常用周期表中第四周期第Ⅷ族;
B为Fe3O4,俗名为磁性氧化铁;
C为Al2O3,可以作耐火材料或治炼铝的原料;
故答案为:第四周期第Ⅷ族;磁性氧化铁;作耐火材料或治炼铝的原料;
(2)A+乙
B是氧化亚铁被氧气氧化为四氧化三铁,反应方程式为:6FeO+O2△
2Fe3O4; △ .
故答案为:6FeO+O2
2Fe3O4; △ .
(3)在加热条件下,Fe与水蒸气反应生成四氧化三铁与氢气,反应方程式为:3Fe+4H2O(g)
Fe3O4+4H2; 高温 .
故答案为:3Fe+4H2O(g)
Fe3O4+4H2; 高温 .
(4)若21.6gFeO的物质的量为
=0.3mol,由铁元素守恒可以生成Fe3O4为0.3mol×21.6g 72g/mol
=0.1mol,Fe3O4中+3价的Fe为0.1mol×1 3
=0.2mol,根据电子转移守恒,2×n(Cl2)=n(Fe3+)×(3-2)=0.2mol×1,故n(Cl2)=0.1mol;2 3
故答案为:0.1mol.
