X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.
请回答:
(1)实验室制取X的离子方程式为______,若制得标准状况下2.24L X,则被氧化的物质的质量为______.
(2)取100mL 0.1mol/L的Y溶液,通入一定量的X时,共转移1.204×1022个电子,该反应的离子方程式是______.
(3)在一种酸性溶液中可能存在Fe3+、NO
、Cl-、I-中的一种或几种离子,向该溶液中加入W,W被还原,由此可推断溶液中一定含有______离子;一定不含有______离子. -3
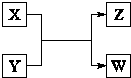
X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体,所以单质W为Br2,X为Cl2;Y、Z是化合物的溶液,说明所以X+Y=Z+W是发生了氧化还原反应;Y溶液呈淡绿色说明Y溶液是亚铁盐溶液,结合判断可知为FeBr2;
(1)实验室制取氯气的离子方程式为:4H++2Cl-+MnO2
Mn2++Cl2↑+2H2O;制得标准状况下2.24L Cl2,物质的量为0.1mol,由离子方程式知,生成1molCl2被氧化的氯化氢为2mol,质量=2mol×36.5g/mol=7.3 g,故答案为:4H++2Cl-+MnO2 加热 .
Mn2++Cl2↑+2H2O;7.3 g; 加热 .
(2)100mL 0.1mol/L的Y溶液中溶质FeBr2物质的量为0.01mol,通入一定量的Cl2时,共转移1.204×1022个电子即物质的量为0.02mol,说明反应的Cl2为0.01mol,依据氧化还原反应中的电子守恒,亚铁离子还原性大于溴离子,亚铁离子全被氧化,溴离子部分氧化,结合定量关系写出反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2;
故答案为:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2;
(3)酸性溶液中可能存在Fe3+、NO
、Cl-、I-中的一种或几种离子,向该溶液中加入Br2被还原,证明溶液中存在还原性的离子I-,根据离子共存可知氧化性的离子Fe3+、NO -3
,不能存在;所以溶液中一定含有I-;一定不含NO3-和Fe3+;故答案为:I-;NO3-和Fe3+. -3
