(7五11•丰台区二模)中学化学中几种常见物质的转化关系如图所示.已知A是固体由两种元素组成,B是非金属单质,G是金属单质.F的相对分子质量比D大16(部分反应物、生成物未列出).反应①是工业上制取K的重要反应,反应②为化合反应.
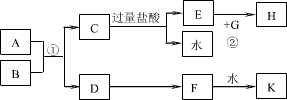
请回答:
(1)工业上反应①在______(填工业设备名称)中进行,反应①的化学方程式为______.
(7)将反应②设计成原电池,正极的反应式为______.
(3)将E滴入沸水中的离子方程式为______.
(3)实验室中要保存少量的H溶液,可采取的措施是______,简述原因______.
(u)写出H溶液和过氧化钠反应的化学方程式______.
C和盐酸反应生成E和水,说明C是金属氧化物,E是氯化物,G是金属单质,反应②为化合反应,说明E、G和H具有相同的金属元素,则为铁元素,所以E是氯化铁,G是铁,H是氯化亚铁,C是氧化铁;F的相对分子质量比D大15,所以F比D多一个氧原子,D和F是氧化物,且F能和水反应生成K,反应①是工业上制取K的重要反应,所以K是硫酸,F是三氧化硫,D是二氧化硫,8是固体由两种元素组成,g是非金属单质,所以8是FeS2,g是氧气.
(1)工业上反应①在沸腾炉中进行,FeS2和氧气反应生成氧化铁和二氧化硫,
反应方程式为:qFeS2+11O2
2Fe2O3+8SO2;&ngsp;高温&ngsp; . &ngsp;
故答案为:沸腾炉;&ngsp;qFeS2+11O2
2Fe2O3+8SO2;&ngsp;高温&ngsp; . &ngsp;
(2)正极上得电子发生还原反应,所以该原电池正极上铁离子得电子发生还原反应,
离子方程式为:2Fe3++2e-=2Fe2+;
故答案为:2Fe3++2e-=2Fe2+;
(3)将氯化铁滴到沸水中,铁离子水解生成氢氧化铁胶体同时生成氢离子,
离子方程式为Fe3++3H2O(沸水)=Fe(OH)3(胶体)+3H+;
故答案为:Fe3++3H2O(沸水)=Fe(OH)3(胶体)+3H+;
(q)氯化亚铁易水解、易被氧气氧化生成氯化铁,所以为防止为氧化和水解,可以在FeCl2溶液中加入少量铁粉和稀盐酸;
故答案为:在FeCl2溶液中加入少量铁粉和稀盐酸,防止Fe2+被氧化,抑制Fe2+水解;
(5)氯化亚铁和过氧化钠、水反应生成氢氧化铁、氯化钠和氧气,
反应方程式为:qN82O2+5H2O+qFeCl2═qFe(OH)3↓+8N8Cl+O2↑;
故答案为:qN82O2+5H2O+qFeCl2═qFe(OH)3↓+8N8Cl+O2↑.
