现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示.
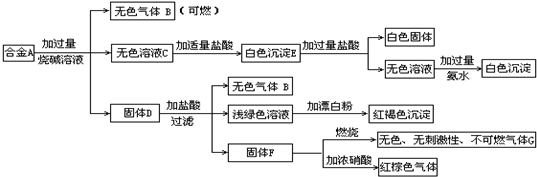
填写下列空白:
(1)A中含单质为为______写化学式)
(2)写出A中的某一单质与烧碱溶液反应的离子方程式______
(3)写出固体F与硝酸反应的化学方程式,并标出电子转移的方向和数目______
(4)将F与浓硝酸反应产生的气体依次通过足量的碳酸氢钠溶液、浓硫酸、足量Na2O2固体、水最终得到的气体与原气体的体积比为______.
合金与氢氧化钠溶液反应,生成无色可燃气体B,B为H2,合金可能含有Al、Si;
合金与氢氧化钠溶液反应,得到的无色溶液C,C中加入盐酸生成白色沉淀E,沉淀E加入过量盐酸,有白色固体,该白色固体为H2SiO3,向加入过量盐酸得到无色溶液中加过量氨水,生成白色沉淀,该白色沉淀为Al(OH)3,故合金含有Si、Al,白色沉淀E为H2SiO3、Al(OH)3;
固体D加入盐酸生成氢气与浅绿色溶液,浅绿色溶液中加入漂白粉,生成红褐色沉淀,为Fe(OH)3,故D中含有铁,即合金中含有铁;
固体D加入盐酸后过滤得到不溶物F,F燃烧生成无色、无刺激性的气体G,与浓硝酸反应生成红棕色气体NO2,F为碳符合转化关系与题意,G为CO2,故合金中含有碳单质,
(1)综合上述分析可知,A中含单质为:Al、Si、C、Fe;
故答案为:Al、Si、C、Fe;
(2)Al与Si都能与氢氧化钠溶液发生离子反应,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑或Si+2OH-+H2O=SiO32-+2H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑或Si+2OH-+H2O=SiO32-+2H2↑;
(3)固体C与浓硝酸反应的化学方程式的方程式为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,反应中电子转移数目为4,标出电子转移的方向和数目为: △ .
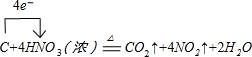
;
故答案为:
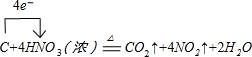
;
(4)固体C与浓硝酸反应的化学方程式的方程式为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,假定生成CO2为1mol、NO2为4mol,产生的气体依次通过足量的碳酸氢钠溶液,发生反应3NO2+H2O=2HNO3+NO,生成 △ .
molHNO3,8 3
molNO,同时发生HNO3+NaHCO3=CO2↑+H2O,4 3
molHNO3可以生成8 3
molCO2,故出来气体中:CO2为1mol+8 3
mol=8 3
mol,NO为11 3
mol,及水蒸气.通过浓硫酸水被吸收,再通过足量Na2O2固体发生反应2Na2O2+2CO2=2Na2CO3+O2,4 3
molCO2生成11 3
molO2,再发生2NO+O2=2NO2,11 6
molNO,消耗4 3
molO2,剩余O2为2 3
mol-11 6
mol=2 3
mol,生成NO27 6
mol,最后发生反应4NO2+O2+2H2O=4HNO3,4 3
molNO2消耗4 3
molO2,最后剩余O2为1 3
mol-7 6
mol=1 3
mol,故最终得到的气体与原气体的体积比为5 6
mol:(1mol+4mol)=1:6;5 6
故答案为:1:6.
