已知甲、乙、丙均为常见气体,其中甲在空气中含量最多,乙在相同条件下密度最小,丙有刺激性气味,且一个丙分子由四个原子构成.
(1)实验室中可用下图A或B装置与相应的药品制得丙.

①A中试管内反应的化学方程式是______.
②B中分液漏斗内盛放的物质丁是______,圆底烧瓶内的物质是______.(均填名称)
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:
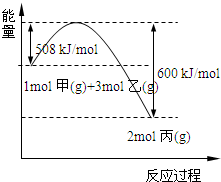
该反应的热化学方程式是______.
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是______.
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是______.
②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | ______ | ______ |
| ______ | 固体全部溶解,有气泡产生 | ______ | ______ |
(1)①实验室用固体氯化铵和氢氧化钙加热制取氨气,反应方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O, △ .
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O; △ .
②实验室还可以用浓氨水和氧化钙或氢氧化钠、碱石灰制取氨气,所以液体是浓氨水,固体是氧化钙或氢氧化钠或碱石灰;故答案为:浓氨水;氧化钙(氢氧化钠或碱石灰);
(2)△H=-(600-508)=-92kJ/mol,所以该反应的热化学反应方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ/mol;
(3)点燃条件下,氨气和氧气反应生成氮气和水,反应方程式为:4NH3+3O2
2N2+6H2O,故答案为:4NH3+3O2 点燃 .
2N2+6H2O; 点燃 .
(4)①氨气和水反应生成氨水,氨水和过量二氧化碳反应生成碳酸氢铵,碳酸氢钠的溶解度小于碳酸氢铵,且原来溶液是饱和溶液,所以会析出碳酸氢钠,离子方程式为:NH3+CO2+H2O+Na+=NaHCO3↓+NH4+,故答案为:NH3+CO2+H2O+Na+=NaHCO3↓+NH4+;
②将固体加热后,有固体剩余,说明该固体不是碳酸氢铵,向冷却后的试管中加入足量盐酸,有气体生成,说明该固体为碳酸盐而不是氯化钠,反应方程式为:CO32-+2H+=H2O+CO2↑,
故答案为:
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 该晶体不是NH4HCO3 | |||
| 向冷却后试管中加入足量盐酸 | 该晶体不是NaCl,是NaHCO3 | CO32-+2H+=H2O+CO2↑ |
| n |
| V |
| ||
| V |
| 1 |
| Vm |
| 1 |
| 22.4 |
