A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀
①A、B、C中含有的同一种常见金属元素为______.
②写出A、C的水溶液混合生成沉淀B的离子反应方程式为______.
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构.
①B的电子式为______.
②C能与水剧烈反应,生成磷酸和盐酸,反应的化学方程式为______.
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生.
①A中所含有的化学键是______.
②将过量X通入水玻璃溶液中,写出反应的离子方程式______.
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L.若取相同质量的固体加热至恒重,剩余固体的质量为______ g.
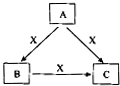
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠.
①A、B、C中含有的同一种常见金属元素为Al.
故答案为:Al.
②A的水溶液含有铝离子,C水溶液含有偏铝酸根,混合反应生成氢氧化铝沉淀,
反应离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3.
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3.
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气.
①B为三氯化磷,各原子都大8电子稳定结构,三氯化磷B的电子式为
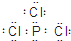
.
故答案为:
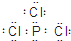
.
②C为五氯化磷,与水剧烈反应,生成磷酸和盐酸,反应的化学方程式为PCl5+4H2O=H3PO4+5HC1.
故答案为:PCl5+4H2O=H3PO4+5HC1.
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳.
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是 离子键、共价键.
故答案为:离子键、共价键.
②x为二氧化碳,将过量二氧化碳通入水玻璃溶液中,生成硅酸与碳酸氢钠,反应的离子方程式为2H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-.
故答案为:2H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-.
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为
| 1 |
| 2 |
故答案为:2.65.
