甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁
(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式______.
(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式______.
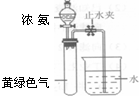
(3)霍夫曼根据上述反应,用右图实验装置测定了氨分子的组成.打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至2/3处.①滴加浓氨水后试管内的现象______②相应的反应化学方程式______
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式______,反应方程式______
(5)某短周期金属元素的单质与核电荷数为其2倍的金属元素的氧化物之间也能发生上述反应,请写出相应的化学方程式______.
(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,说明是乙炔制备反应,碳化钙和水的反应,丙为乙炔,结构式为:H-C≡C-H,
故答案为:H-C≡C-H;
(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,第三周期中同周期和水发生置换反应的是金属钠,判断甲为Na,反应是Na和水的反应,其离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)①试管中黄绿色气体是氯气,浓氨水滴入发生氧化还原反应生成氮气和氯化氢,滴下浓氨水至不再反应为止,氨水过量氯气全部反应,生成的氯化氢和氨气反应生成氯化铵固体,产生大量白烟,黄绿色气体消失,故答案为:产生大量白烟,黄绿色气体消失;
②相应的反应化学方程式为:8NH3+3Cl2=N2+6NH4Cl,故答案为:8NH3+3Cl2=N2+6NH4Cl;
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,氯气是氧化剂物质的量=
=0.3mol,还原剂为氯化铵,依据电子守恒:Cl2~2Cl-~2e-;0.3mol氯气反应转移电子为0.6mol,设氯化铵中氮元素化合价变为x,则:NH4Cl~N~(x+3)e-;0.1mol×(x+3)=0.6mol.x=+3,则生成的氮的氯化物为:NCl3,反应的化学方程式为:3Cl2+NH4Cl═NCl3+4HCl,故答案为:NCl3 ;3Cl2+NH4Cl═NCl3+4HCl;6.72L 22.4L/mol
(5)金属和金属氧化物反应说明是发生了铝热反应,反应的化学方程式为:2Al+3FeO
Al2O3+3Fe或4Al+2Fe2O3催化剂 . △
2Al2O3+4Fe 或8Al+3Fe3O4催化剂 . △
4Al2O3+9Fe,故答案为:2Al+3FeO催化剂 . △
Al2O3+3Fe或4Al+2Fe2O3催化剂 . △
2Al2O3+4Fe 或8Al+3Fe3O4催化剂 . △
4Al2O3+9Fe.催化剂 . △
