已知A为烃,B为烃的含氧衍生物.由等物质的量的 A 和 B 组成的混合物 0.05mol 在0.125mol 的氧气中恰好完全燃烧,生成 0.1mol 的 CO2 和 0.1mol H2O,试通过计算回答下列问题:
(1)从分子式的角度看,等物质的量A 和 B 组成的混合物平均组成可用化学式表示为______,
(2)另取一定量的A和B完全燃烧,将其以任意物质的量比混合,且物质的量之和一定,则:
①若耗氧量一定,则A和B的结构简式分别为:A______ B______
②若生成的CO2 和 H2O 的物质的量一定,则A和B的结构简式为:A______ B______.
由A和B的混合物0.05mol燃烧生成0.1 molCO2和0.1molH2O以及耗氧量,可知A和B的混合物平均组成分子式为C2H4O.由于A为烃,B为烃的含氧衍生物,且A和B为等物质的量,根据平均值含义(如A与B中碳原子数确定,有两种可能:一种情况是两者碳原子数均为2;另一情况是一种碳原子数大于2,一种碳原子数小于2),A、B的组合可能有五种.分别是CH4和C3H4O2、C2H4和C2H4O2、C2H2和C2H6O2、C2H6和C2H2O2、C3H6和CH2O2.
(1)依题中燃烧反应数据可知:1 mol混合物+2.5 molO2→2 molCO2+2mol H2O,从质量守恒的角度的可知混合物的平均分子式为C2H4O,故答案为:C2H4O;
(2)①由于A为烃,B为烃的含氧衍生物,则B中必含2个O原子,将其以任意物质的量比混合,且物质的量之和一定时,两者碳原子数均为2,应为CH≡CH和
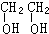
,
故答案为:CH≡CH;
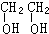
;
②若生成的CO2 和 H2O 的物质的量一定,则两种物质中含有的C和H原子数相同,应为CH2=CH2和CH3COOH,
故答案为:CH2=CH2;CH3COOH.
