A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.
请回答下列问题:
(1)若B是黄绿色气体,C、F是空气的主要成分,A、D相遇有白烟生成,则该白烟的化学式为______,反应③的化学方程式为______.
(2)若A、D、F都是非金属单质,A、D所含元素同主族,A、F所含元素同周期,则B所属晶体类型是______,其一个重要的用途是______.
(3)若A是常见的金属单质,D、F是气态单质,反应①②在水溶液中进行,则反应②的离子方程式为______.工业上冶炼金属A的反应原理是(用化学方程式表示)______.
(4)若A、D是常见单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,反应③④中都有红棕色气体生成.则反应①的化学方程式为______.
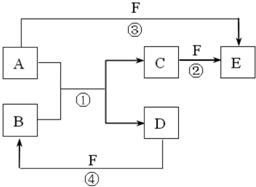
(1)若B是黄绿色气体应为Cl2,C、F是空气的主要成分,结合转化关系F为O2,由于氧的氧化性较氯气稍强,故氯气置换出的应该是氮气,C为N2,C+F→E,为N2+O2
2NO;A、D相遇有白烟生成,所以发生反应为NH3+HCl=NH4Cl,判断A为NH3,D为HCl;该白烟的化学式为:NH4Cl;反应③是氨气催化氧化为一氧化氮的反应,化学方程式:4NH3+5O2 放电 .
4NO+6H2O催化剂 . △
故答案为:NH4Cl;4NH3+5O2
4NO+6H2O;催化剂 . △
(2)若A、D、F都是非金属单质,A、D所含元素同主族,A、F所含元素同周期,反应A+B→C+D是非金属间的置换反应,可以分析第ⅣA、ⅥA、ⅤⅡA 主族元素单质间的置换反应,结合转化关系中 F的反应,只有2C+SiO2=Si+2CO 符合,所以A为C,B为 SiO2; 原子晶体(2分);任选一种(2分).二氧化硅属于原子晶体,主要用途为:光导纤维、石英钟表、石英玻璃等,
故答案为:原子晶体;光导纤维、石英钟表、石英玻璃等;
(3)若A是常见的金属单质,D、F是气态单质,反应①②在水溶液中进行,结合能与F连续反应,说明存在变价,可以推断出是铁和盐酸的反应;则反应②的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;工业上冶炼金属Fe的反应原理为一氧化碳还原氧化铁,反应的化学方程式为:Fe2O3+3CO
2Fe+3CO2; 高温 .
故答案为:2Fe2++Cl2=2Fe3++2Cl-;Fe2O3+3CO
2Fe+3CO2 高温 .
(4)若A、D是常见单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,结合原子结构可知是镁置换碳的反应,反应③④中都有红棕色气体生成,说明生成了NO2,则F为浓硝酸,反应①的化学方程式为2Mg+CO2
2MgO+C; 点燃 .
故答案为:2Mg+CO2
2MgO+C; 点燃 .
