问题
实验题
现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取样品10克,并用下图所示装置进行实验,得到以下两组实验数据.
| 反应前 | 氧化铁完全反应后 | |
| A组 | 玻璃管和氧化铁样品的质量43.7g | 玻璃管和固体物质的质量41.3g |
| B组 | 烧杯和澄清石灰水的质量180g | 烧杯和烧杯中物质的质量186.2g |
(2)这位同学所用实验装置的不足之处是 .
答案
A 80% 没有处理含有CO的尾气
题目分析:用质量差法去计算;
不用B组数据去计算,因为不知氢氧化钙是否足量,即反应过程中生成的二氧化碳无法确定是否被完全吸收完,故不知二氧化碳的质量,所以无法计算.
解:(1)应该用A组数据计算,而不用B组数据(反应过程中生成的二氧化碳无法确定是否被完全吸收完,故不知二氧化碳的质量,所以无法计算).
因为反应前玻璃管和固体样品的质量是43.7g,反应结束后玻璃管和固体样品的质量是41.3g,质量减少2.4g,设该反应中参加反应的 Fe2O3为x则
3CO+Fe2O3=2Fe+3CO23×28 160 3×44△=3×44﹣3×28=48
x 2.4
解答x=8
所以Fe2O3的质量分数=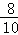 ×100%=80%
×100%=80%
故选A;80%
(2)CO有毒,不能直接排入空气中,
故答案为:没有处理含有CO的尾气.
点评:本题属于选择实验方案的题目,当给出多种实验方案是要会理清思路,选出正确的实验方案.
