A、B、C、D和甲有以下转化关系.已知物质甲是短周期元素组成的盐,且是某种消毒液的有效成分,沉淀D可溶于酸.请回答下列问题:
(1)组成A的元素在周期表中位于第______ 周期第______族.
(2)鉴定C中阳离子(不考虑H+)的操作和现象是______.
(3)A转化为B时会放出无色气体E,在298K时1mol A完全反应放出热量QkJ,则该反应的热化学方程式为______.
(4)若A转化为C时无气体放出,写出该反应的化学方程式:______.
(5)写出溶液C和溶液甲反应的离子方程式:______.
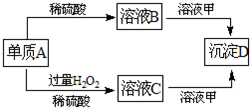
物质甲是短周期元素组成的盐,且是某种消毒液的有效成分,甲为NaClO,单质A与稀硫酸反应生成B,A为金属,B为硫酸盐,单质A与稀硫酸、过氧化氢反应生成C,可知金属A为变价金属,故A为Fe,B为FeSO4,C为Fe2(SO4)3,FeSO4溶液与次氯酸钠溶液,发生氧化反应与水解反应,生成Fe(OH)3,Fe2(SO4)3溶液与次氯酸钠溶液发生水解反应,生成Fe(OH)3,D为Fe(OH)3,
(1)由上述分析可知,A为Fe,为26号元素,在周期表中位于第四周期第Ⅷ族;
故答案为:四、Ⅷ;
(2)C为Fe2(SO4)3,检验Fe3+方法是:取少量C溶液于试管中,滴入KSCN溶液,溶液显红色,说明C中有Fe3+离子;
故答案为:取少量C溶液于试管中,滴入KSCN溶液,溶液显红色,说明C中有Fe3+离子;
(3)在298K时1molFe与硫酸完全反应生成硫酸亚铁与氢气,放出热量QkJ,则该反应的热化学方程式为:Fe(s)+2H+ (aq)=Fe2+(aq)+H2(g);△H=-QkJ/mol;
故答案为:Fe(s)+2H+ (aq)=Fe2+(aq)+H2(g);△H=-QkJ/mol;
(4)铁与稀硫酸、过氧化氢反应生成硫酸铁与水,该反应的化学方程式:2Fe+3H2O2+3H2SO4=Fe2(SO4)3+6H2O;
故答案为:2Fe+3H2O2+3H2SO4=Fe2(SO4)3+6H2O;
(5)Fe2(SO4)3溶液与次氯酸钠溶液发生水解反应生成Fe(OH)3,反应的离子方程式为:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO;
故答案为:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO.
