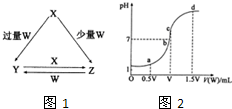
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
(1)若X为金属单质,W是某强酸的稀溶液.X与少量W反应生成Z的离子方程式为______,向Y溶液中加入某种试剂______(填试剂名称),若溶液出现血红色,即可判断Y溶液中阳离子的存在.
(2)若X、Y为正盐,X的水溶液显酸性,W为NaOH溶液,写出Y与X在水溶液中转化为Z的离子反应方程式______.
(3)若X为强碱,常温下W为有刺激性气味的气态氧化物.常温时,将Z的水溶液露置于空气中,溶液的PH变化是______(填“变大”、“变小”、“不变”.不考虑水的挥发),其原因是______(用简要的文字说明,并写出离子方程式)
(4)室温下,若用0.1mol/L的NaOH溶液滴定VmL0.1mo1/L HA溶液,滴定曲线如2图所示,则a、b、c、d四点溶液中水的电离程度最大的是______点;a点溶液中离子浓度的大小顺序为______;取少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外,离子浓度的大小顺序为______.
(1)若X为金属单质,W是某强酸的稀溶液,当W的量不同时产物不同,则X是变价金属,为Fe,该酸是稀硝酸,铁和少量稀硝酸反应生成硝酸亚铁、一氧化氮和水,离子反应方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,铁离子遇硫氰化钾溶液显血红色,所以选取检验铁离子的试剂是硫氰化钾,
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;硫氰化钾;
(2)若X、Y为正盐,X的水溶液显酸性,W为NaOH溶液,则X是铝盐,铝盐和偏铝酸盐反应生成氢氧化铝沉淀,离子反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)若X为强碱,常温下W为有刺激性气味的气态氧化物,则二氧化硫,氢氧化钠和少量二氧化硫反应生成亚硫酸钠Z,亚硫酸钠不稳定,易被空气中氧气氧化生成硫酸钠,导致溶液的pH变小,
故答案为:变小;亚硫酸根离子有还原性,易被空气中的氧气氧化生成硫酸根离子,2SO32-+O2=2SO42-,所以溶液的pH变小;
(4)根据图象知,该酸是弱酸,a、b、c、d点的溶质分别是盐和酸、盐和酸、盐、碱和盐,酸或碱抑制水电离,含有弱根离子的盐促进水电离,所以a、b、c、d四点溶液中水的电离程度最大的是C;a点溶液中存在等物质的量浓度的盐和酸,酸的电离程度大于酸根离子的水解程度,所以溶液呈酸性,溶液中离子浓度大小顺序是c(A-)>c(Na+)>c(H+)>c(OH-),c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,溶液中存在的溶质是氯化钠、NaA,因为C点碱性较弱,所以加入的盐酸的量较少,则氯离子浓度小于A-,根据电荷守恒知离子浓度大小顺序是c(Na+)>c(A-)>c(Cl-),
故答案为:c;c(A-)>c(Na+)>c(H+)>c(OH-);c(Na+)>c(A-)>c(Cl-).
