如图1,A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去).
请回答以下问题:
(1)写出原电池的负极反应方程式______.
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为______(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者______后者(用“>”、“<”或“=”表示).
(3)金属A的氯化物沸点较低,又易升华,能否电解这种熔融氯化物来生产A?______.原因是______.
(4)写出②的化学方程式______.
(5)写出A→J反应的化学方程式______.
(6)含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色.则:
①水溶液与NaHCO3溶液混合,反应的离子方程式为:______
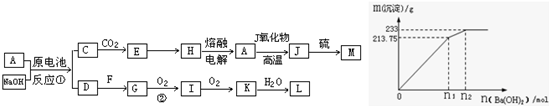
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图2:请回答:X晶体的俗名为______;其溶液的物质的量浓度为______mol/L.
(1)题中H→A为工业冶炼金属铝,A→J为铝热反应,为推断题的突破口,依次可知C→E→H→A→J的转化是中学化学中常见反应,为AlO2-→Al(OH)3→Al2O3→Al→Fe之间的转化,该原电池是铝做负极,铁做正极,电解质溶液为NaOH,可以推知:A为Al,C为NaAlO,E为Al(OH)3,H为Al2O3,J为Fe,M为FeS,原电池中,Al做负极被氧化,在碱性溶液中生成AlO2-,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O;
(2)溶液C为NaAlO2,根据溶液呈电中性,即c(AlO2-)+c(OH-)=c(Na+)+c(H+)可知:c(Na+)-c(AlO2-)=c(OH-)-c(H+)=10-2-10-12 mol/L,故答案为:10-2-10-12 mol/L或c(OH-)-c(H+);
(3)金属A的氯化物为AlCl3,为共价化合物在熔融状态下不导电,故答案为:否;因为A的氯化物熔沸点低,据此判断它的晶体为分子晶体,在熔融态时不电离,不能被电解;
(4)原电池正极生成H2,即D为H2,则G为氢化物,由G→I→K的转化可知该氢化物中存在变价非金属元素,应为N元素,故G为NH3,I为NO,K为NO2,L为HNO3,反应②为工业合成氨的重要反应,反应为:4NH3+5O2
4NO+6H2O,催化剂 . △
故答案为:4NH3+5O2
4NO+6H2O 催化剂 . △
(5)反应A→J为铝热反应,反应为:Fe2O3+2Al
2Fe+Al2O3 故答案为:Fe2O3+2Al 高温 .
2Fe+Al2O3 高温 .
(6)①AlCl3水溶液与NaHCO3溶液反应相互促进的水解,反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,该反应为泡沫灭火器的反应原理,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
②含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色,说明盐中含有铝元素和钾元素,为明矾,俗称为明矾或白矾;
根据反应计算:
Ba2++SO42-═BaSO4
1mol 233g
n 233g
则n=1mol,根据SO42-离子的守恒可知500mLKAl(SO4)2的溶液中含有溶质的物质的量为0.5mol,
故浓度为:
=1mol/L,故答案为:明矾或白矾;1mol/L.0.5mol 0.5L
