A、B、C、D是中学化学常见的四种物质,它们的转化关系如下:A+B=C+D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子式为______;分子的稳定性B______M(填“>”、“<”或“=”).
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是______.将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是______mol.
(3)若A、B、C、D发生反应:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g),根据如图所示信息,
①反应是______反应(填“放热”或“吸热”),判断依据是______.
②若△H=aKJ/mol,当消耗标况下5.6LCO2时的反应热△H=______KJ/mol.
③在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是______(填字母序号).
A.生成1molCH3CH2OH的同时,生成3molH2OB.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化.

(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,A、C为同种元素氧化物,应是二氧化氮与水反应生成硝酸与NO,A为NO2、B为H2O、C为NO、D为硝酸,则A中非氧元素的气态氢化物M为NH3,NH3分子中N原子与H原子之间形成1对共用电子对,其电子式为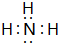 ,非金属性O>N,故氢化物稳定性H2O>NH3,
,非金属性O>N,故氢化物稳定性H2O>NH3,
故答案为: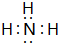 ;>;
;>;
(2)B是黑色有磁性的氧化物,B为Fe3O4,若A、D是两种单质,为置换反应,故D为Fe,Fe3O4与盐酸反应生成FeCl3、FeCl2溶液,取少许溶液于试管中,加入K3Fe(CN)6溶液,若出现蓝色沉淀则说明有Fe2+,将Fe加入上述溶液中,发生反应Fe+2Fe3+=3Fe2+,28gFe的物质的量=
=0.5mol,反应中Fe元素化合价由0价升高为+2,故转移电子物质的量=0.5mol×2=1mol,28g 56g/mol
故答案为:取少许溶液于试管中,加入K3Fe(CN)6溶液,若出现蓝色沉淀则说明有Fe2+;1;
(3)①由图可知,反应物总能量大于生成物总能量,该反应为放热反应,
故答案为:放热;反应物总能量大于生成物总能量;
②5.6L二氧化碳的物质的量=
=0.25mol,图中△H=aKJ/mol,表示2mol二氧化碳反应时的反应热,故5.6LCO2时的反应热△H=aKJ/mol×5.6L 22.4L/mol
=0.125aKJ/mol,0.25mol 2mol
故答案为:0.125a;
③A.生成1molCH3CH2OH的同时,生成3molH2O,反应始终按此比例进行,不能说明到达平衡,故A错误;
B.平衡时,反应混合物各组分的物质的量浓度不随时间而变化,故B正确;
C.容器的容积不变,混合气体的总质量不变,混合气体密度始终不变,密度不随时间而变化,不能说明到达平衡,故C错误;
D.正反应为气体物质的量减小的反应,容器中气体的分子总数不随时间而变化,说明到达平衡,故D正确,
故选BD.