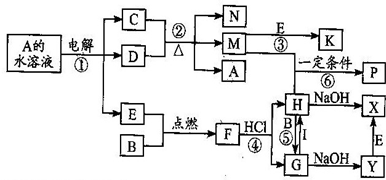
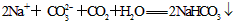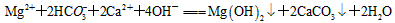已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,A为硫酸盐反应②为D的溶液与C在加热条件下的反应,P溶液和G溶液中具有相同的阳离子,请根据要求回答下列问题.
(1)B元素在周期表的位置:______,
(2)物质I的电子式:______.
(3)Y转变为X的现象是:______.涉及的反应方程式为:______.
(4)写出反应④的化学反应方程式:______.物质F与HI水溶液的离子反应方程式 式:______.
(5)向沸水中加入H的饱和溶液,可得到红褐色溶液,其溶液所具有性质______.
A.具有丁达尔效应
B.处加直流电源阳极附近溶液颜色加深
C.加入盐酸溶液出现先沉淀后溶解的现象
D.能透过半透膜,不能透过滤纸
(6)向含1molG的溶液中加入1molNa2O2,所发生的离子反应方程式:______.
A为硫酸盐,电解硫酸盐溶液,阳极上生成氧气E,阴极上析出金属单质C,说明金属单质C的活动性小于氢元素,且C为常见的金属单质,所以C是铜,则D是硫酸,A是硫酸铜;加热条件下,浓硫酸和铜反应生成硫酸铜、二氧化硫和水,水和硫酸铜都不与氧气反应,二氧化硫和氧气反应生成三氧化硫,所以M是二氧化硫,N是水,K是三氧化硫;B是金属,H和B反应生成G,G和I反应生成H,说明B是变价金属,且是常见金属,所以B是铁,铁和氧气反应生成四氧化三铁F,四氧化三铁和盐酸反应生成氯化铁和氯化亚铁,H和铁反应生成G,所以H是氯化铁,G是氯化亚铁,氯化亚铁和I反应生成氯化铁,则I是氯气,氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,氯化亚铁和氢氧化钠反应生成氯化钠和氢氧化亚铁,Y和氧气能生成X,所以X是氢氧化铁,Y是氢氧化亚铁,二氧化硫和氯化铁溶液反应生成硫酸根离子、亚铁离子.
(1)铁在周期表中位于第四周期第ⅤⅢ族,故答案为:第四周期第ⅤⅢ族;
(2)氯气的电子式为:
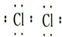
,故答案为:
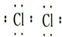
;
(3)氢氧化亚铁是白色沉淀,但不稳定,迅速变成灰绿色,最终变成红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色絮状沉淀迅速变为灰绿色,最终转化为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)四氧化三铁和盐酸反应生成氯化亚铁、氯化铁和水,反应方程式为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,四氧化三铁和氢碘酸反应生成亚铁离子、碘单质和水,
离子方程式为Fe3O4+2I-+8H+=I2+3Fe2++4H2O,故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;Fe3O4+2I-+8H+=I2+3Fe2++4H2O;
(5)向沸水中加入H的饱和溶液,可制得氢氧化铁胶体,胶体的性质有:丁达尔效应、电泳、产生聚沉现象、不能透过半透膜,
A.氢氧化铁胶体具有丁达尔效应,故正确;
B.氢氧化铁胶粒带正电,加直流电源后,阴极附近溶液颜色加深,故错误;
C.加入盐酸溶液先出现聚沉现象,后盐酸和氢氧化铁反应生成氯化铁,所以出现的现象是先沉淀后溶解,故正确;
D.胶体粒子不能透过半透膜,能透过滤纸,故错误;
故选AC;
(5)向含1mol氯化亚铁溶液中加入1molNa2O2,根据得失电子数相等知,过氧化钠过量,过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为Na2O2+H2O═2NaOH+
O2↑,氯化亚铁和氢氧化钠、氧气反应生成氢氧化铁和氯化钠,反应方程式为:2FeCl2+4NaOH+1 2
O2+H2O═2Fe(OH)3↓+4NaCl,所以总的反应方程式为:4FeCl2+4Na2O2+6H2O═4Fe(OH)3↓+8NaCl+O2↑,离子方程式为:4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑,故答案为:4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑.1 2