在下图各物质的相互转化关系中:甲、乙、丙为三种金属单质;A、C、D常温下为气体,其中C呈黄绿色;G为白色沉淀;H为红褐色沉淀;B溶液焰色反应显黄色.(图中部分反应条件及生成物未全部标出)

填写下列空格:
(1)已知甲原子的质量数为23,则原子核内的中子数为______.
(2)F的化学式______.
(3)乙元素原子的结构示意图为______.
(4)写出B与乙反应生成A的离子反应方程式______
(5)写出上述反应①的化学反应方程式并标出电子转移的方向与总数______.
甲、乙、丙为三种金属单质;A、C、D常温下为气体,其中C呈黄绿色判断为Cl2;G为白色沉淀;H为红褐色沉淀判断为Fe(OH)3;G为Fe(OH)2,B溶液焰色反应显黄色说明含有钠元素,金属甲和水反应生成气体A和碱B,金属乙和碱反应证明为Al,所以B为NaOH,甲为Na,A为H2,D为HCl,E为盐酸溶液,依据G的成分可知F一定含铁元素,因此丙为Fe,金属铁和盐酸溶液反应生成F为FeCl2;
(1)已知甲原子的质量数为23,甲为Na,原子的质子数为11,依据质子数+中子数=质量数;则原子核内的中子数为12;
故答案为:12;
(2)上述推断可知,F为氯化亚铁的化学式为:FeCl2;
故答案为:FeCl2;
(3)乙元素为铝元素,原子的结构示意图为:
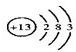
;故答案为:

;
(4)B为NaOH与乙为Al反应生成A为H2,反应的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)反应①是钠和水反应生成氢氧化钠和氢气的反应,钠失电子水中的氢元素原子得到电子,依据反应电子守恒,化学反应方程式中标出电子转移的方向与总数为:
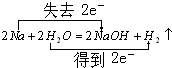
故答案为:;
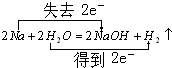
;
