A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:
(1)E的结构式是______,F的电子式是______
(2)写出F与D反应的离子方程式并标出电子转移的方向和数目______
(3)物质Z与B互为同素异形体,它常用于对空气进行杀菌、净化和水果保鲜等.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是______.
(4)取0.3mol F与足量D充分混合后,再通入0.4mol E恰好完全被吸收,所得溶液中各种离子的浓度由大到小的顺序是______.
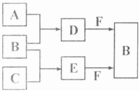
常温下D为无色液体,应为H2O,E是一种常见的温室气体,应为CO2,则A为H2,B为O2,C为C元素形成的单质,F为Na2O2,则
(1)CO2为直线形分子,结构式为O=C=O,Na2O2为离子化合物,电子式为
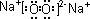
,
故答案为:O=C=O;
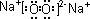
;
(2)F与D发生反应为2Na2O2+2H2O=4Na++4OH-+O2↑,反应中Na2O2自身发生氧化还原反应,得失电子可表示为
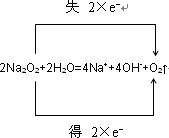
,
故答案为:

;
(3)Z应为O3,与KI反应生成O2和I2,反应的离子方程式为O3+2H++2I-=O2+I2+H2O,
故答案为:O3+2H++2I-=O2+I2+H2O;
(4)0.3mol与足量水反应生成NaOH0.6mol,与0.4molCO2反应生成NaHCO3和Na2CO3,
根据n(CO2):n(NaOH)=0.4mol:0.6mol=2:3,可将化学方程式为写为:2CO2+3NaOH=NaHCO3+Na2CO3+H2O,
由方程式可知,n(NaHCO3)=0.2mol,n(Na2CO3)=0.2mol,
由于CO32-水解生成HCO3-,则c(HCO3-)>c(CO32-),溶液呈碱性,则c(OH-)>c(H+),
一般来说,盐类的水解程度较小,则有c(CO32-)>c(OH-),
故有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
