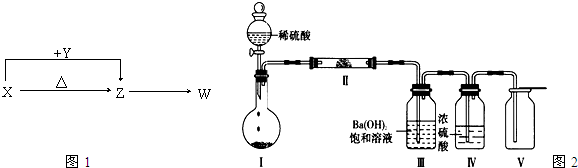
X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有图1所示的转化关系(部分反应物、产物及反应条件已略去):
请回答:
(1)W的化学式是______.
(2)X与Y在溶液中反应的离子方程式是______.
(3)①将4.48L(已折算为标准状况)W通入100mL3mol/L的Y的水溶液后,溶液中的溶质是______.
②自然界中存在X、Z和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol/L.若取相同质量的固体加热至恒重,剩余固体的质量为______ g.
(4)Ⅰ和Ⅱ中为X所含有的四种元素中的两种或三种组成的化合物,并利用图2装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色助燃性气体.
①装置Ⅱ中物质的化学式是______.
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是______,所需仪器装置是______ (从上图选择必要装置,填写编号).
X、Y、Z的焰色反应均为黄色,说明化合物三者均为钠元素的.X含有四种元素,在加热条件下能生成Z,这四种化合物均为短周期元素组成,且W为无色无味的气体(中学阶段常见的无色无味的气体为H2、O2、CO2等),可推出X为NaHCO3,Y为NaOH,Z为Na2CO3,W为CO2.
(1)由以上分析可知W为CO2,故答案为:CO2;
(2)X与Y在溶液中反应是NaHCO3+NaOH=Na2CO3+H2O,离子方程式是HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(3)①n(CO2)=
=0.2mol,n(NaOH)=0.3mol,发生2CO2+3NaOH=Na2CO3+NaHCO3+H2O,生成物为Na2CO3和NaHCO3,4.48L 22.4L/mol
故答案为:Na2CO3和NaHCO3;
②溶液中金属阳离子的浓度为0.5mol/L,应为钠离子,则n(Na+)=0.05mol,加热后固体为Na2CO3,n(Na2CO3)=0.025mol,m(Na2CO3)=0.025mol×106g/mol=2.65g,故答案为:2.65;
(4)①根据装置Ⅲ中Ba(OH)2饱和溶液产生白色沉淀,且图示中装置I、Ⅱ中的物质均为固体,推测装置I中的物质为NaHCO3或Na2CO3固体.装置Ⅰ中反应的化学方程式:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O;因为装置Ⅴ中收集到一种无色气体,说明装置I中产生的CO2与装置Ⅱ中的物质反应生成了另一种无色气体,进而推测出装置Ⅱ中的物质为Na2O2,故答案为:Na2O2;
②装置Ⅴ中收集的气体是O2.O2的制取也可以用2H2O2
2H2O+O2↑进行,所需仪器装置是Ⅰ、Ⅳ、Ⅴ,故答案为:H2O2;Ⅰ、Ⅳ、Ⅴ. MnO2 .
