如图中各方框中的字母表示有关的一种反应物或生成物(某些物质略去),其中A分解得B、C、D、F四种物质,且它们的物质的量相同,常温下B、D、G、I、J、Q为气体,其中B可使湿润的红色石蕊试纸变蓝,N为不溶于水的无机酸.
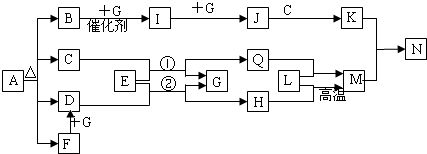
回答下列问题:
(1)A的名称为______,L的化学式是______
(2)写出实验室制取I的离子方程式:______
(3)写出G的一种同素异形体的化学式:______该物质与G在化学性质上的共同点是______.
(4)已知工业上生产0.1molB放出4.62kJ热量,写出该反应的热化学方程式:______
(5)通过反应①②处理过的空气,需______才适合人类呼吸.
A分解得B、C、D、F四种物质,且它们的物质的量相同,B可使湿润的红色石蕊试纸变蓝,则B为NH3,由转化关系可知,G为氧气,则I为NO,J为NO2,C不是气体,则C为H2O,K为HNO3,再结合F→D,则F为CO,D为CO2,即A分解生成氨气、水、一氧化碳、二氧化碳,所以A为草酸氢铵;结合反应①②可知,E为Na2O2,Q为NaOH,H为Na2CO3,则Q、H都与L反应生成M,N为不溶于水的无机酸,N为H2SiO3,则L为SiO2,M为Na2SiO3,
(1)由上述分析可知,A为草酸氢铵,L为SiO2,故答案为:草酸氢铵;SiO2;
(2)I为NO,实验室制取NO的离子方程式为3Cu+8H++2NO3-3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-3Cu2++2NO↑+4H2O;
(3)G的一种同素异形体为O3,与氧气都具有氧化性,故答案为:O3;具有氧化性;
(4)生产0.1molNH3放出4.62kJ热量,则生成2molNH3放出4.62kJ×
=92.4kJ热量,所以N2(g)+3H2(g)⇌2NH3(g)△H=-92.4k J•mol-1,2 0.1
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4k J•mol-1;
(5)通过反应①②处理过的空气,过氧化钠将二氧化碳、水均反应转化为氧气,缺少水蒸气,不利用人类呼吸,则应适当补充水蒸气,故答案为:适当补充水蒸气.
