X、Y、Z是中学化学中常见的单质或化合物,它们能实现如图所示的转化关系:
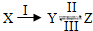
(1)若X是一种金属单质,X、Z分别与一种阴阳离子均为10电子物质的溶液反应都能生成Y.
①写出Y的化学式______,
②写出单质X与铁红反应的化学方程式______,
③写出反应I的离子方程式______.
(2)若Y是一种黄绿色气体,X是黑色粉末,Z是一种呈碱性的钠的化合物且能用于漂白物质.
①写出II的离子方程式______,
②反应I中若有0.1molX参加反应,生成Y气体的体积是______(STP),
(3)X、Y、Z三种物质中含有同一种元素,Z为非金属单质,Y为气体,则Z为______,反应II的化学方程式为______.
(1)一种阴阳离子均为10电子物质的溶液应为NaOH溶液,则X为Al,Y为Na[Al(OH)4],Z为Al(OH)3,
①由以上分析可知Y为Na[Al(OH)4],故答案为:Na[Al(OH)4];
②Al可与氧化铁在高温下反应,用于冶炼铁,反应的化学方程式为2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3 高温 .
Al2O3+2Fe; 高温 .
③反应Ⅰ为铝和强碱溶液的反应,反应的离子方程式为2Al+2OH-+6H2O
2[Al(OH)4]-+3H2↑, 点燃 .
故答案为:2Al+2OH-+6H2O
2[Al(OH)4]-+3H2↑; 点燃 .
(2)若Y是一种黄绿色气体,应为Cl2,X是黑色粉末,应为MnO2,Z是一种呈碱性的钠的化合物且能用于漂白物质,应为NaClO
①氯气在碱性条件下自身发生氧化还原反应,反应II的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
②反应I为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,若有0.1molMnO2参加反应,生成Cl2气体的物质的量为0.1mol,体积是2.24L. △ .
故答案为:2.24L;
(3)X、Y、Z三种物质中含有同一种元素,Z为非金属单质,Y为气体,常见反应为碳酸盐生成二氧化碳,二氧化碳与镁反应生成碳,Z为C,反应II的化学方程式为
CO2+2Mg
2MgO+C, 点燃 .
故答案为:C; CO2+2Mg
2MgO+C. 点燃 .
