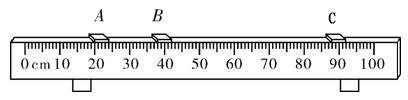
已知①~④均为工业生产及应用的常见反应.其中常温下B、D、J、P气体,E为分子中原子个数比为1:l的液体.A的相对分子质量为120.(个别反应的产物已略去)
试回答下列问题:
(1)反应F与N溶液反应的离子方程式为______;
(2)反应⑤中当有1mol电子转移时,氧化剂消耗______g;
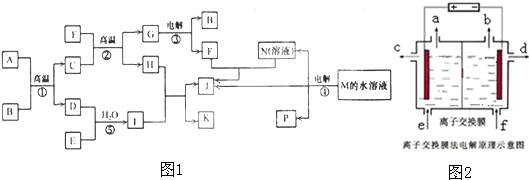
(3)反应④的离子方程式为______;如图2是该反应原理的示意图,该装置中使用的是______(填“阴”或“阳”)离子交换膜,图中从d处收集到的是______.
(4)工业上由D制取I的过程可表示为:
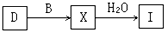
由D与B反应生成X的反应所用的设备是______;
①高炉 ②沸腾炉 ③接触室 ④分馏塔 ⑤吸收塔
已知400℃101Kpa时,2D(g)+B(g⇌2X(g);△H=-196.6KJ/mol,当2mol D与1mol B在该条件下反应达平衡时反应放热186.8KJ.在实际生产中综合考虑各种因素,为提高D的转化率,工业选择了以下哪些条件______.
①适当升高温度 ②增大压强 ③使用合适的催化剂 ④及时移走生成物
⑤适当增大B的浓度 ⑥将反应物与生成物在热交换器中进行热交换.
(1)反应F(Al)与N(NaOH)溶液反应的离子方程式为:2Al+2OH-+2H20=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H20=2AlO2-+3H2↑;
(2)反应⑤为H2O2+SO2=H2SO4,1mol氧化剂H2O2发生反应,电子转移2mol,中当有1mol电子转移时氧化剂H2O2物质的量0.5mol,质量=0.5mol×34g/mol=17g;故答案为:17g;
(3)反应④是电解食盐水的反应,反应的离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;该装置中使用的是阳离子交换膜,阴极d处收集到的是NaOH溶液; 电解 .
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH- NaOH溶液; 电解 .
(4)由D(SO2)与B(O2)反应生成X(SO3)的反应,是二氧化硫气体的催化氧化,在接触室中进行,反应为2SO2(g)+
O2(g)⇌2SO3(g);△H=-196.6KJ/mol;为提高SO2的转化率,需要平衡正向进行,在实际生产中综合考虑各种因素分析;
①反应是放热反应,升温平衡逆向进行,二氧化硫转化率减小,故①错误;
②增大压强平衡向气体体积减小的方向进行,二氧化硫转化率增大,但高温催化剂作用下二氧化硫转化率已经很高,增大压强提高不大,故②错误;
③催化剂只改变速率,不改变平衡,故③错误;
④及时移走生成物,平衡正向进行,二氧化硫转化率增大,④正确;
⑤适当增加氧气的浓度会提高二氧化硫的转化率,故⑤正确;
⑥将反应物与生成物在热交换器中进行热交换,是反应产生的温度降低,促进平衡正向进行,故⑥正确;
故选④⑤⑥;
故答案为:③;④⑤⑥;