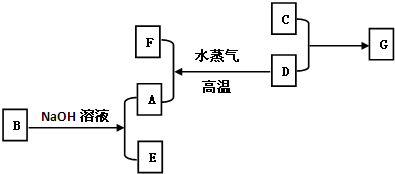
A、B、C、D是四种常见单质,其对应元素的核电荷数依次增大,其中B、D属于常见金属,E、F、G化合物.所有物质之间有如下的转化关系
(1)写出D→A+F的化学方程式:______;
(2)写出B→A+E的离子方程式:______.
(3)将G的饱和溶液滴入沸水中可形成红褐色的透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是______;
(4)向含0.1molE的溶液中滴加5mol/L的盐酸溶液,得到沉淀3.9g,则加入盐酸体积为______mL.
A、B、C、D是四种常见单质,其对应元素的核电荷数依次增大,其中B、D属于常见金属,E、F、G化合物,依据转化关系分析可知,D+水蒸气=F+A推断D为Fe,生成的单质A为H2,B是常见金属和氢氧化钠反应说明是Al,E为NaAlO2,依据(3)将G的饱和溶液滴入沸水中可形成红褐色的透明液体,说明是氢氧化铁胶体的生成,所以通过分析判断G为FeCl3,C为单质确定,C为Cl2;
(1)D→A+F的反应是铁和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O (g)
Fe3O4+4H2,高温 .
故答案为:3Fe+4H2O (g)
Fe3O4+4H2;高温 .
(2)B→A+E的反应是铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)将G的饱和溶液滴入沸水中可形成红褐色的透明液体,是制备的胶体为氢氧化铁胶体,是利用氯化铁滴入沸水中生成,氢氧化铁胶体吸附带正电荷的微粒,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,氢氧化铁胶体发生电泳现象,移向阴极,在阳极端可观察到的现象是附近红褐色变浅,
故答案为:红褐色变浅;
(4)向含0.1mol E为NaAlO2的溶液中滴加5mol/L 的盐酸溶液,得到沉淀3.9g物质的量=
=0.05mol,生成沉淀的反应可以是盐酸和偏铝酸钠反应生成氢氧化铝沉淀,依据盐酸物质的量计算,反应的化学方程式为:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;或加入盐酸反应先生成最大量氢氧化铝沉淀后,继续加入盐酸,沉淀溶解最后剩余氢氧化铝沉淀3.9g;3.9g 78g/mol
若盐酸全部反应恰好反应生成氢氧化铝沉淀,则
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
0.05mol 0.05mol
需要盐酸的体积=
=0.01L=10ml;0.05mol 5mol/L
若加入的盐酸生成最大量沉淀后,继续加入盐酸氢氧化铝溶解剩余3.9g,则
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
0.1mol 0.1mol0.1mol
Al(OH)3+3HCl=AlCl3+3H2O
0.1mol-0.05mol=0.05mol 0.15mol
过程中消耗盐酸溶液中氯化氢物质的量=0.1mol+0.15mol=0.25mol;
需要盐酸的体积=
=0.05L=50ml;0.25mol 5mol/L
故答案为:10和50.