如图是A~G各物质间的转化关系,其中B、D为气态单质.
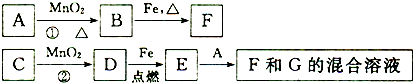
请回答下列问题:
(1)物质A和E的名称分别为______、______.
(2)反应①的化学方程式为______.
(3)反应②可选用不同的C物质来进行,若能在常温下进行,其化学方程式为______;若只能在加热情况下进行,则反应物C应为______.
(4)工业上F可通过多种途径转化成G.
①在F溶液中加入适量氢碘酸,发生反应的离子方程式为______.
②将无水F在氮气做保护气下加热至300℃-350℃,通入干燥H2,而制得G.该反应的化学方程式为______.
③另一种制备G的方法是:将无水的F与适量氯苯(C6H5Cl),在130℃持续加热约3小时,可发生如下反应:
2F+C6H5Cl
2G+C6H4Cl2+HCl130℃
根据有机反应规律,该反应中氯苯发生的是______(填有机反应类型).
④分析上述三个反应,下列有关说法正确的是:______.
A.反应①中,氢碘酸既表现了酸性,又表现了还原性
B.反应③中,HCl为氧化产物
C.上述三个反应中,G均为还原产物.
在二氧化锰催化条件下,C反应生成D且不需加热,H2O2水解生成H2O和O2,所以C是H2O2,
铁在D中点燃,所以D是O2,铁在O2中燃烧生成Fe3O4;
加热条件下,A和二氧化锰反应,能和二氧化锰反应的物质是浓盐酸、氯酸钾,B、D不是同一种物质,所以A是浓盐酸,B是Cl2,
铁和Cl2反应生成FeCl3,所以F是FeCl3铁;
Fe3O4和浓盐酸反应生成FeCl3、FeCl2,所以G是FeCl2,
(1)由以上分析可知A为浓盐酸,E为四氧化三铁,
故答案为:浓盐酸;四氧化三铁;
(2)①为浓盐酸和二氧化锰在催化剂条件下加热生成氯气的反应,反应的方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,△ .
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;△ .
(3)反应②可选用不同的C物质来进行,若能在常温下进行,双氧水分解生成水和氧气,反应方程式为2H2O2
2H2O+O2↑,若只能在加热情况下进行,反应物C是KClO3,MnO2 .
故答案为:2H2O2
2H2O+O2↑;KClO3;MnO2 .
(4)①氯化铁和氢碘酸能发生氧化还原反应生成氯化亚铁和碘单质,离子方程式为:2Fe3++2I-═I2+2Fe2+,
故答案为:2Fe3++2I-═I2+2Fe2+;
②在氮气做保护气下加热至300℃-350℃下,氯化铁和氢气反应生成氯化亚铁、氯化氢,反应方程式为2FeCl3+H2
2FeCl2+2HCl,△ .
故答案为:2FeCl3+H2
2FeCl2+2HCl;△ .
③该反应中,苯环的氢原子被取代,则有机反应类型为取代反应,
故答案为:取代反应;
④A.反应①中,氢碘酸只表现了还原性;
B.反应③中,Cl元素化合价没有发生变化;
C.上述三个反应中,氯化铁被还原性生成氯化亚铁,则G均为还原产物.
故答案为:C.
