(6分)生活离不开金属。
(1)右图“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠和水等,其发热原理是利用铁生锈时放热。
发热剂需与空气中 接触才会发热。

(2)已知下列各组物质间均能发生置换反应。
A.Fe 和CuSO4溶液 B.Mg和MnSO4溶液 C.Mn和FeSO4溶液
①写出Fe 和CuSO4溶液反应的化学方程式 。
②Mn、Fe、Mg 、Cu四种金属的活动性由强到弱的顺序 。
(3)化学小组在实验结束后,进行了如下废液处理:
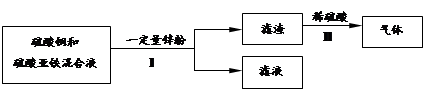
①Ⅰ中的操作名称是___________。
②写出Ⅱ中一定发生反应的化学方程式 ___ _________ 。
③滤液的组成可能是 。
(1)氧气
(2)①Fe+CuSO4=FeSO4+Cu
②Mg>Mn>Fe>Cu
(3)①过滤
②Fe+H2SO4=FeSO4+ H2↑
③ZnSO4或ZnSO4和FeSO4的混合物(答不全不得分)
题目分析:(1)发热剂主要成分有铁粉、活性炭、氯化钠和水等,其发热原理是利用铁生锈时放热。故热剂需与空气中氧气反应才能发热。
(2)①Fe 和CuSO4溶液反应的化学方程式为Fe+CuSO4=FeSO4+Cu。
②Mn、Fe、Mg 、Cu四种金属的活动性由强到弱的顺序为Mg>Mn>Fe>Cu。
(3)①Ⅰ是将固体和液体分离的操作,名称是过滤。
②滤渣中一定会有铁被置换出来。故Ⅱ中一定发生反应的化学方程式为:Fe+H2SO4=FeSO4+ H2↑。
③滤液的组成可能是ZnSO4或ZnSO4和FeSO4的混合物,要根据锌的质量多少来确定,若锌足量,则滤液为ZnSO4溶液;若锌不足,则滤液为ZnSO4和FeSO4的混合物。
点评:本题难度一般,注意在解答最后一题时,要考虑加入锌的量,根据量的多少,来讨论反应后滤液中物质的种类。
