甲、乙、丙是中学中常见的单质,X、Y、Z是常见的化合物.在常温常压下,甲是具有氧化性的黄绿色气体,丙是棕红色的液体,Y与Z含有相同的阳离子,X与Z含有相同的阴离子;它们之间有以下转化关系:丙+乙→Z;X+丙→Z;X+甲→Y+丙.请回答下列问题:
(1)写出甲、乙、丙三种物质的化学式______、______、______;
(2)写出X与足量的甲在溶液中完全反应时的离子方程式______
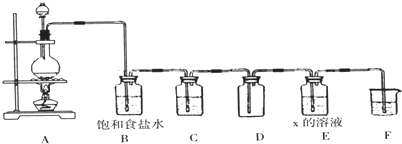
(3)欲在实验室中制取并收集纯净、干燥的气体甲,然后完成上述反应“X+甲→Y+丙”,某同学设计了如下图所示的装置.
①装置A中发生反应的化学方程式为______;
②装置B的作用是______;
③装置C中的试剂为______;
④装置D中收集气体甲的方法名称是______;
⑤装置F的主要作用是______,反应原理的离子方程式为______.
甲、乙、丙是中学中常见的单质,X、Y、Z是常见的化合物.在常温常压下,甲是具有氧化性的黄绿色气体,则甲为Cl2,丙是棕红色的液体,则丙为Br2,它们之间有以下转化关系:丙+乙→Z;X+丙→Z;X+甲→Y+丙,X与Z含有相同的阴离子,则阴离子为Br-,结合转化关系可知,X、Z含有相同的元素,Y与Z含有相同的阳离子,阳离子中元素为变价元素,可推知乙为Fe,故Z为FeBr3、X为FeBr2、Y为FeCl3,
(1)由上述分析可知,甲为Cl2,乙为Fe,丙为Br2,故答案为:Cl2;Fe;Br2;
(2)FeBr2与足量的氯气在溶液中完全反应时的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,
故答案为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
(3)①装置A制备氯气,实验室利用二氧化锰与浓盐酸在加热条件下制备,反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,△ .
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;△ .
②盐酸易挥发,制备的氯气中含有HCl,用饱和食盐水吸收挥发出来的HCl气体,
故答案为:吸收挥发出来的HCl气体;
③C装置应用干燥氯气,应盛放浓硫酸,
故答案为:浓硫酸;
④氯气的密度比空气大,用向上排空气法收集,
故答案为:向上排空气法;
⑤尾气中有未反应的氯气,直接排放,会污染空气,用氢氧化钠溶液吸收,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:吸收多余的氯气,防止污染环境;Cl2+2OH-=Cl-+ClO-+H2O.
