各物质间的转化关系如下图所示:
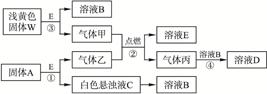
(1)写出反应③的化学方程式: ,生成标准状况下5.6 L气体甲,则转移电子的物质的量为 mol。
(2)固体A是一种重要的工业原料,1 mol气体乙完全燃烧时生成1 mol E与2 mol丙,则乙的电子式为 。
(3)C溶液中的溶质和丙以物质的量之比1∶2反应时,该反应的离子方程式为: 。
(4)利用图中的有关物质,实现C→B的转变,该物质为 (填写化学式)。
(5)若甲和乙恰好完全反应,则A与W的物质的量之比为 。
(1)2Na2O2+2H2O 4NaOH+O2↑ 0.5
4NaOH+O2↑ 0.5
(2) 
(3)OH-+CO2 HCO
HCO
(4)Na2CO3(或NaHCO3)
(5)1∶5
据题意,淡黄色固体W可能为Na2O2,则甲为O2;固体A为重要的化工原料,与E反应生成白色悬浊液C和气体乙,而1 mol 乙在甲(O2)中完全燃烧生成1 mol E和2 mol丙,则A为CaC2,E为H2O,乙为C2H2,丙为CO2,C为Ca(OH)2。C〔Ca(OH)2〕溶液中的溶质和丙(CO2)以物质的量之比1∶2反应,则生成Ca(HCO3)2,离子方程式为:OH-+CO2 HCO
HCO 。
。
甲(O2)和乙(C2H2)恰好完全反应:
2C2H2+5O2 4CO2+2H2O
4CO2+2H2O
2Na2O2+2H2O 4NaOH+O2↑
4NaOH+O2↑
CaC2+2H2O Ca(OH)2+C2H2↑
Ca(OH)2+C2H2↑
则2CaC2~2C2H2~5O2~10Na2O2
故A(CaC2)中W(Na2O2)的物质的量之比为1∶5。
