有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
| ② | |||
| ⑦ | ⑧ |
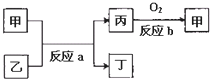
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素位于同一主族,任写一个符合条件的反应a的化学方程式:______.
(1)元素②所处主族的位置为所有主族的正中间,应为ⅣA族元素,由在周期表中的位置可知应为C,则⑦为S元素,⑧为Cl元素,
由此可知元素②位于周期表第二周期第IVA族,元素周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下逐渐增大,则原子半径C<Cl<S,非金属性
C<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则为HClO4>H2SO4>H2CO3,
故答案为:二;IVA;C<Cl<S;HClO4>H2SO4>H2CO3;
(2)单质乙与单质丙所含元素位于同一主族,且反应为置换反应,由反应b可知甲为氧化物,应为单质和氧化物之间的置换反应,常见有Na+H2O→NaOH+H2,C+SiO2→Si+CO等,反应的方程式为2Na+2H2O=2NaOH+H2↑或2C+SiO2
Si+2CO↑,高温 .
故答案为:2Na+2H2O=2NaOH+H2↑或2C+SiO2
Si+2CO↑.高温 .
