下列物质A~F是我们熟悉的单质或化合物,其中A是一种常见的金属;B常温下是黄绿色气体;单质C含有的元素是位于元素周期表中第一周期ⅠA族;E是无色溶液.在适当的条件下,它们可以按下面框图进行反应.
试回答下列问题:
(1)B的分子式是______;C的分子式是______;E的电子式是______.
(2)反应①的化学方程式是______.
(3)反应②的离子方程式是______.
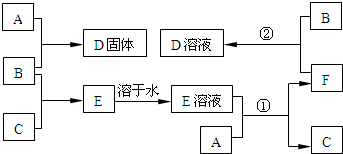
B常温下是黄绿色气体,则B为Cl2,单质C含有的元素是位于元素周期表中第一周期IA族,则C为H2,B与C反应生成的E为HCl,E溶液为盐酸,A是一种常见的金属,与盐酸反应生成氢气与金属氯化物F,F能与氯气反应生成D,则A为变价金属,可推知A为Fe,D为FeCl3,F为FeCl2,
(1)由上述分析可知,B为,C为H2,E为HCl,其电子式为 ,
,
故答案为:Cl2;H2; ;
;
(2)反应①的化学方程式为Fe+2HCl=FeCl2+H2↑,
故答案为:Fe+2HCl=FeCl2+H2↑;
(3)反应②的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-.
