(7分)水是重要的自然资源。
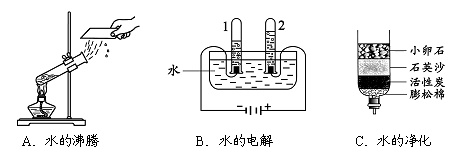
(1)下图所示的3个实验,A中水发生了 (填“物理”或“化学”)变化;B中试管1内得到的气体为 ;C中净化水的方法是 和吸附。
(2)将源水处理成自来水需要加入消毒剂。其中用液氯消毒时发生反应的微观过程如右图:
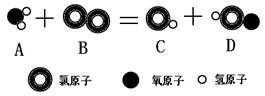
该反应的化学方程式为___________,D物质中氯元素的化合价是________。
(3)部分地区的天然水中Ca2+、Mg2+含量超标,称为硬水,需要软化,即降低Ca2+、Mg2+含量。
①煮沸一定程度上可以起到软化作用,因为在煮沸过程中,溶于水中的碳酸氢钙[Ca(HCO3)2]会发生如下反应:Ca(HCO3)2=CaCO3↓+CO2↑+H2O,若水中含有较多的Ca(HCO3)2,煮沸过程中可能观察到的现象是 。
②煮沸不能被软化的硬水通过化学反应进行软化。纯碱(Na2CO3)是常用的水软化剂,碳酸钠溶液与水中的氯化钙反应生成碳酸钙和一种生活必需品,反应的化学方程式为 。
(7分)每空1分
(1)物理;氢气(H2);过滤
(2)Cl2+H2O="HCl+HClO" ; +1
(3)①水变浑浊,有气泡冒出。②CaCl2+Na2CO3 =CaCO3↓+ 2NaCl
(1)水沸腾是物理变化,电解水的实验中,两极上的气体是正氧负氢;净化水的实验中,小卵石和石英沙起过滤作用,活性炭起吸附作用.故答案为:物理;氢气(H2);过滤;
(2)氯气和水反应生成盐酸和次氯酸,根据正负化合价的代数和为零求氯元素的化合价为+1价,故答案为:Cl2+H2O=HCl+HClO;+1;
(3)碳酸氢钙受热分解生成白色沉淀碳酸钙和水和二氧化碳,因此现象是:变浑浊,有气泡冒出.碳酸钠溶液与水中的氯化钙反应生成碳酸钙和氯化钠,配平即可.故答案为:水变浑浊,有气泡冒出;CaCl2+Na2CO3=CaCO3↓+2NaCl
