某化学兴趣小组用含A.B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中A.B两种金属单质常温下遇浓H2SO4表面均可形成一层致密的氧化物薄膜,E为白色沉淀,I为红褐色沉淀.
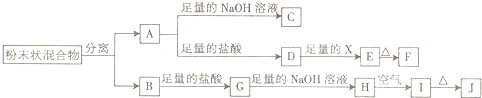
(1)写出下列物质的化学式:F______,G______.
(2)分离混合物最简单的方法是______.
(3)D→E转化中,加入足量的X,试剂X可能是______.
A.饱和NaCl溶液B.NaOH溶液C.氨水D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:A→C:______;H→I:______.
A.B两种金属单质的粉末状混合物,其中A.B两种金属单质常温下遇浓H2SO4表面均可形成一层致密的氧化物薄膜,判断为Fe和Al,转化关系中分析可知A和酸、碱反应判断A为Al,B为Fe,则C为NaAlO2,D为AlCl3,E为白色沉淀说明是氢氧化铝沉淀,证明X为碱溶液,F为Al2O3,I为红褐色沉淀为Fe(OH)3,H为Fe(OH)2,J为Fe2O3,G为FeCl2;
(1)上述分析判断F为氧化铝,化学式为Al2O3;G为氯化亚铁,化学式FeCl2,
故答案为:Al2O3;FeCl2;
(2)分离铝和铁最简单的方法是用磁铁把铁析出,
故答案为:用磁铁靠近粉末状混合物,将铁粉吸附在磁铁的表面;
(3)D为AlCl3,E为白色沉淀说明是氢氧化铝沉淀,证明X为碱溶液,D→E转化中,加入足量的X生成白色沉淀,依据氢氧化铝溶于强碱,不溶于弱碱可知,选择氨水溶液符合要求,
故答案为:C;
(4)A-C反应是铝和氢氧化钠溶液的反应,反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;H-I反应是氢氧化亚铁和氧气反应生成氢氧化铁的反应,化学方程式为:4Fe(0H)2+O2+2H2O═4Fe(OH)3,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;4Fe(0H)2+O2+2H2O═4Fe(OH)3.
