(15分)现有A、B、C、D、E、F六种中学常见的元素,其原子序数依次增大。①D的一种含氧酸根离子与H+结合生成D的单质、D的氧化物和水;该D的氧化物通入品红溶液,溶液褪色,加热溶液又变红色;②在短周期元素中,只有C的氧化物和烧碱反应生成的溶液与过量盐酸混合产生白色沉淀;③A与D的原子最外层电子数相同;④B的单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑤E有多种含氧酸,其氧化性与“同元素价态越高,其氧化性越强”一般规律相悖,它是生活调味品和农药的组成元素 ⑥E单质+F单质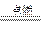 红棕色烟,D单质+F单质
红棕色烟,D单质+F单质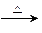 黑色固体,A单质+F单质
黑色固体,A单质+F单质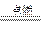 黑色固体。F的最高价钾盐是一种绿色环保型净水剂。
黑色固体。F的最高价钾盐是一种绿色环保型净水剂。
根据上述信息,回答下列问题:
(1)A的简单离子结构示意图为 ;具有强氧化性的E的含氧酸结构式为 ;
(2)向一定量的烧碱溶液中缓慢通入DA2,得到中性溶液,其溶质的化学式为 ;
(3)下列“根据”能证明B、F单质活泼性强弱的是 ;
a.根据它们分别与D单质反应产物的价态
b.根据它们最高价氧化物的水化物在氢氧化钠溶液中溶解情况
c.根据它们分别与盐酸反应产生气泡快慢
d.根据它们在空气中稳定性
(4)工业上冶炼C单质的化学方程式为 。
(5)CE4在湿空气中产生大量白雾,可以用于海战。写出发生的化学方程式: 。
(6)C、D、E最高价氧化物对应的水化物酸性强弱顺序为(用化学式表示): 。
(1)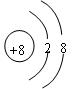 H-O-Cl (4分)
H-O-Cl (4分)
(2)Na2SO3和NaHSO3(3分)
(3)c (2分)
(4)SiO2+2C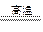 Si+2CO↑ (2分)
Si+2CO↑ (2分)
(5)SiCl4+3H2O=H2SiO3+4HCl↑(2分)
(6)HClO4>H2SO4>H2SiO3(H4SiO4)(2分)
由①信息知,D的氧化物为二氧化硫,该含氧酸根离子为S2O32-,即D为硫;根据②信息,C的钠盐与过量盐酸反应产生白色沉淀,说明C的含氧酸难溶于水,又因为C在硫元素之前,硅酸是短周期元素中唯一一种难溶于水的酸,故C为硅;由信息③知,A与硫同主族,A为氧;由信息④推知,B为铝;根据信息⑤,E为氯,因为高氯酸中氯呈+7价,但高氯酸氧化性弱,而次氯酸具有强氧化性。由信息⑥知,F为铁,铁在氧气中燃烧产生黑色四氧化三铁,铁在氯气中燃烧生成红棕色氯化铁,铁与硫反应生成硫化亚铁。高铁酸钾(K2FeO4)或高铁酸钠(Na2FeO4)既能杀菌又能净水。(1)次氟酸、次氯酸、次溴酸、次碘酸分子中,氧与氢形成共价键,结构式为H-O-X,习惯写成HXO;(2)向氢氧化钠溶液中通入二氧化硫,得到溶液的溶质可能是:Na2SO3,NaOH(碱性);Na2SO3(碱性);NaHSO3(酸性);NaHSO3,H2SO3(酸性)等溶液都不可能呈中性,含亚硫酸钠和亚硫酸氢钠的溶液可能呈中性。(3)铝只有+3价,铁有+2价、+3价,不能根据铝、铁与硫反应生成产物价态判断铝比铁活泼;氢氧化铁不溶于氢氧化钠,氢氧化铝溶于氢氧化钠,但不能根据这一性质判断铁比铝活泼,最高价氧化物的水化物与碱反应情况只能判断同周期元素性质递变;接触面相近,金属与同浓度同种稀无氧化性酸反应,由反应剧烈程度判断金属活泼性强弱;铁在空气中易生锈,铝表面生成一层保护膜,性质稳定,不是因为铝本身性质稳定,由此不能判断铝、铁性质活泼性;(4)工业上用焦炭还原二氧化硅制备粗硅。
