(12分)A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、b. c.d.е;且3 (a+b) =" 2" (a+c) =" 3" (d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
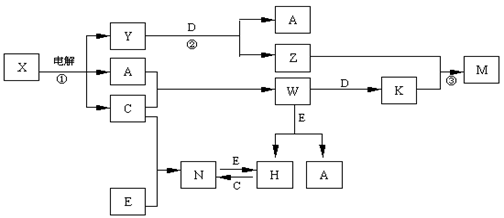
(1)Y的电子式为 ,构成D单质的元素在周期表中位于 周期 族。
(2)反应③的离子方程式为 E的氧化物与D在一定条件下反应的化学方程式为: 。
(3)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断
N为 型晶体。
(4)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为 。
(1)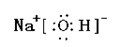 ;三;ⅢA
;三;ⅢA
(2)Al3++3AlO2-+6H2O = 4Al(OH)3
Fe2O3+2Al  2Fe + Al2O3 (Fe2O3若写成FeO或Fe3O4并配平也可以)
2Fe + Al2O3 (Fe2O3若写成FeO或Fe3O4并配平也可以)
(3)分子
(4)1∶104
由题意可推知:A 是氢气;B是钠;C 是氯气;D 是铝;E是铁;X 是氯化钠溶液;Y是氢氧化钠溶液;Z是偏铝酸钠;M是氢氧化铝;N是氯化铁;W是氯化氢;H是氯化亚铁;K是氯化铝。
(1) Y的电子式为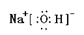 ,构成D单质的元素在周期表中位于第三周期ⅢA族。
,构成D单质的元素在周期表中位于第三周期ⅢA族。
(2) (2)反应③的离子方程式为:Al3++3AlO2-+6H2O = 4Al(OH)3↓
E的氧化物与D在一定条件下反应的化学方程式为:Fe2O3+2Al  2Fe + Al2O3
2Fe + Al2O3
(3) 由题意知,N的沸点很低,所以是分子晶体。
(4) 25℃时,PH=5的氯化氢和氯化铁的水溶液中由H2O电离出来的H+离子浓度分别为10-9、10-5,所以,由H2O电离出来的H+离子浓度之比为1∶104
