(15分)有X、Y、Z、W四种短周期元素原子序数依次增大,它们之间可以同时相互形成A2B2型、AB型、A2型、A22—型等具有相同电子数的微粒。
(1)当A2型微粒为空气的主要成分时:
①写出上述A22—型微粒电子式 _______________。
②写出四种元素原子按5:1:1:3形成的离子化合物与足量NaOH反应的离子方程式_______________。
(2)当A2型微粒为最活泼的单质时:
①1mol A2B2型化合物分解转移电子的物质的量为_______。
②任写出一种具有相同电子的其他非极性分子的有机物化学式__________
③比较Z与W两种元素的氢化物的沸点与水溶液的酸性。沸点________________酸性______________。
(1)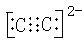 NH4++HCO3—+2OH—=NH3·H2O+CO32—+H2O
NH4++HCO3—+2OH—=NH3·H2O+CO32—+H2O
(2)1mol(3分) ; C2H6 (3分) ;沸点:HF>HCl 酸性HCl>HF
本题的元素推断以电子数为特征,重点以元素化合物知识为学科内综合的载体,落实基本概念、基本理论、化学计算。以“A2”型分子为突破口。常见的由短周期元素形成的A2型分子有5种:H2、N2、O2、F2、Cl2然后进行变换推导。如果当A2型微粒为空气的主要成分时,可假设电子数为14,那么A2型分子为N2,AB型分子为CO,A2B2型分子为C2H2(电子数N相当于CH),因为制备乙炔的离子化合物碳化钙中存在C22—离子也是14电子,所以X、Y、Z、W四种短周期元素依次为H、C、N、O。若为16电子,找不到A2B2微粒。当A2型微粒为最活泼的单质时,那么A2型分子为F2,则这些微粒的电子数为18,A2B2型分子为H2O2(电子数F相当于OH),O22—也是含有18电子,AB型分子为HCl,X、Y、Z、W四种短周期元素依次为H、O、F、Cl。
