(15分)物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物。 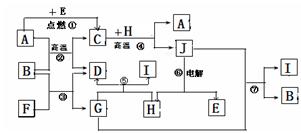
试回答下列有关问题:
(1)A在元素周期表的位置 周期 族
(2)以上7个化学反应属于非氧化还原反应的是 (用编号①→⑦填写)
(3)写出反应①是 ;
(4)写出引发反应④的实验操作
写出该反应一种重要的工业用途
(5)反应⑤的化学方程式是 。
(5)写出用A与H作电极材料插入G溶液闭合电路后的正极反应式是
。
(1) 四 Ⅷ(2分)
(2) ⑦(2分)
(3) 3Fe+4H2O(g) Fe3O4+4H2 (3分)
Fe3O4+4H2 (3分)
(4) 加少量KClO3,插上镁条并将其点燃(2分),
焊接钢轨(制高熔点金属)(其他合理答案也给分)(2分)
(5) 2H2O+2e-=2OH-+H2↑(3分)
此题明显的突破口单质E和单质F在点燃或加热的条件下生成淡黄色的固体,马上知道是Na202,说明E、F一定为Na和02。结合反应②条件是高温,马上就推出,E是02,F是Na(Na活泼不需要高温)。结合由B常温下为液态化合物,推出B为是水,D为H2,G为NaOH。反应⑤与NaOH反应产生氢气的单质中学阶段只有Al和Si,结合⑥电解推出H为Al,J为Al2O3。由反应②高温条件下产生氢气体的单质有Fe和C,结合反④高温条件得到Al2O3,那只有A是Fe。验证反应⑦符合条件。写出用Fe与Al作电极材料插入电解溶液NaOH ,总方程式是:2NaOH+2Al+2H2O =2NaAlO2+3H2↑,总方程式减去负极反应式2Al+8OH--6e-=2AlO2-+4H2O即为正极反应式:6H2O+6e-=6OH-+3H2↑。
