现有E、F、H、I、G、K六种原子序数依次增大的前四周期主族元素,且分属四个不同周期,E、G同主族,F、H、I为同周期相邻的三种元素,其中F元素形成的化合物种类是所有元素中最多的,I、G简单离子具有相同的电子层结构,K与F形成的离子化合物Q与E和I形成的常见共价化合物R之间的反应是实验室常见的可燃气体制备原理。(题中的字母只代表元素代号,与实际元素符号无关),请回答下列问题:
(1)E~K六种元素原子,原子半径第三大的是 (填对应的元素符号,下同)。
(2)E与H两种元素组成一种阳离子,该离子的结构式为 。
(3)I、G两种元素组成含有两种化学键的化合物,该化合物的电子式为
。
(4)下图为常温下向25mL 0.1 mol·L-1由E、I、G组成的化合物W溶液中逐滴滴加0.2 mol·L-1E、F、I组成相对分子质量为60的一元酸Z溶液过程中溶液pH的变化曲线。
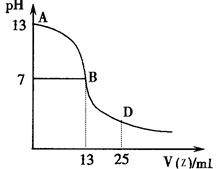
①上图能确定Z为 (“强”或“弱”)酸,理由是
②B点溶液呈中性,有人据此认为,在B点时W与Z恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)。
(5)写出Q与R之间的化学反应方程式 。
(1)C (2)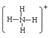 (3)
(3)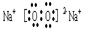
(4)①弱;若Z为强酸则在pH=7是刚好完全反应,体积消耗Z溶液12.5mL,而现在是13ml,说明生成的强碱弱酸盐。 ②否 AB (5)CaC2+2H2O →C2H2↑+Ca(OH)2
首先根据题给信息推断元素。F元素形成的化合物种类是所有元素中最多的,F为碳元素,F、H、I为同周期相邻的三种元素,依次为碳、氮、氧。E、G同主族,I、G简单离子具有相同的电子层结构,E为氢,G为钠,K与F形成离子化合物Q,与碳元素形成离子化合物的元素为钙,离子化合物为碳化钙(Q),与水(R)反应生成乙炔。
六种元素原子半径大小关系:Ca>Na>C>N>O>H,第三大为碳元素(回答元素符号),E与H组成阳离子NH4+(回答结构式),I、G组成含有两种化学键的化合物Na2O2(回答电子式),Q与R反应制备乙炔(回答化学方程式)。
E、I、G组成NaOH与E、F、I组成的一元酸Z中和,若Z为强酸,恰好反应(pH=7)时,消耗酸体积应该为12.5mL,而题中反应至中性时消耗Z的体积为13mL,所以生成强碱弱酸盐。二者恰好反应的点位于AB区间。
