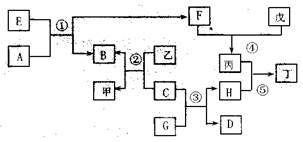
(15分)下图表示某些常见物质之间的转化关系(反应条件已略去),其中A、D为气态非金属单质,B、C为金属单质,B为红色,E、F、G、H为化合物,G为无色液体,甲、乙、丙、丁、戊为溶液,丙为强酸的稀溶液。①、②均为工业冶炼B的反应。
请回答下列问题:
(1)F由同族两种元素组成,可用于食物增白,也是大气污染物之一,污染来源主要是 ,它在大气中可形成丙,反应的化学方程式为 。反应④也可以生成丙,反应的离子方程式为 ;
(2)由反应①制得的金属B含杂质,工业上用 方法将B提纯至99.95%以上。利用热还原制得的金属C,也含杂质,在潮湿的中性环境中,C较易发生腐蚀,化学方程式为 ,C经反应③的处理,表面生成黑色晶体H后,可减缓蚀;
(3)检验溶液丁中金属离子的方法是 ;
(4)E可由单质直接化合得到,则E的化学式为 ,反应①的化学方程式为 。
(1)化石燃料的燃烧(合理均给分)(1分)
2SO2+O2+2H2O=2H2SO4(分开可得分)(2分)
SO2+H2O2=2H++SO42-(2分)
(2)电解精炼(2分),2Fe+O2+2H2O=2Fe(OH)2(1分);
4Fe(OH)2+O2+2H2O=4Fe(OH)3(1分);
2Fe(OH)3=Fe2O3·xH2O+(3-x)H2O(1分)(也可将上述方程式全部或部分加和)
(3)取少量丁溶液于试管中,加入KSCN溶液显红色证明有Fe3+(1分);另取一定量丁溶液加入到盛有酸性KMnO4溶液的试管中,溶液褪色,证明有Fe2+(1分)
(4)Cu2S(1分);Cu2S+O2 2Cu+SO2(2分)
2Cu+SO2(2分)